Применение диатомита
Кроме того, Кольтгофом и Стенжером было показано, что сильнокислой среде гидроксилированная поверхность кремнезёма активно адсорбирует ионы Fe3+ и Al3+ с образованием кислотных групп на его поверхности [2, 237]. Реакция сопровождается вытеснением протонов и снижением концентраций исследуемых ионов в растворах. Можно предположить, что именно этим объясняется уменьшение величины ΔрН при рНисх<2,7.
Гидроксилированная поверхность кремнезёма имеет точку нулевого заряда при рН~2 [3, 913]. При более высоких значениях рН она проявляет слабые кислотные свойства, а при рН >~6 степень ионизации возрастает, и водород Si―OH группы легче диссоциирует. Переходя в раствор, протоны уменьшают степень его кислотности. Кроме того, при рН>7 – 8 растворимость кремнезёма начинает заметно расти [3, 66]. Как показано Р. Айлером, реакции гидратации и деполимеризации происходят с участием гидроксил-ионов (см. рис. 1.3), но при рН<8 образовавшийся силикат-ион гидролизуется с образованием молекул растворимого кремнезёма Si(OH)4 и ионов ОН‾ [2, 91], поэтому при рН<9,6 буферное действие породы, проявлялось слабее, чем в кислой среде. При рН>10,7 кремнезём весь растворяется с образованием силикат-ионов, что приводит к понижению концентрации гидроксил-ионов в растворе извлечения.
При термической активации происходит частичная дегидратация силанольной поверхности аморфного кремнезёма и для её регидратации требуется многодневное выдерживание образцов в нейтральном водном растворе [3, 915]. Это значительно ослабляет буферное действие опаловой составляющей диатомита, прокалённого при 850°С. Частичное разрушение алюмосиликатов снижает адсорбцию протонов с их участием и изменяет значение показателей выхода железа и алюминия. В целом диатомит, прокалённый при 850°С, обладает менее выраженным буферным действием по сравнению с нативным.
Влияние порошка нативного диатомита на концентрацию Al3+ в растворе AlCl3 в зависимости от значения рН раствора извлечения
В присутствии порошка нативного диатомита происходило заметное снижение концентрации алюминия в растворе AlCl3 c исходной CAl3+ 0,0086 мг/см3 и установленными значениями рН:
· рНисх 1,4-4,9 – отмечалось значительное уменьшение содержания алюминия в фильтрате по сравнению с раствором извлечения вплоть до CAl3+ =0 при рН 4,9;
· рНисх 4,9-12,4 – было зафиксировано присутствие ионов Al3+ в исследуемых растворах, с максимальной концентрацией 0,0038 мг/см3 при рН 8,29;
· рНисх 12,38 – CAl3+ в фильтрате равна нулю.
Повышение концентрации исследуемого иона в фильтрате по срав- нению с раствором извлечения отмечалось только при рН<~2-2,5.
Данные, отражающие влияние нативного диатомита на значение CAl3+ в фильтрате в зависимости от рН раствора извлечения, приведены в таблице 2.17 и отражены на графике, приведённом на рисунке 2.12.
Таблица 2.17
Влияние нативного диатомита на значение CAl3+ в фильтрате в зависимости от значения рН раствора извлечения:
|
рН исх | 1,40 | 2,15 | 2,65 | 4,90 | 8,29 | 9,65 | 12,38 |
|
CAl3+, мг/см3 | 0,0164 | 0,0062 | 0,0010 | 0,0000 | 0,0038 | 0,0017 | 0,0000 |
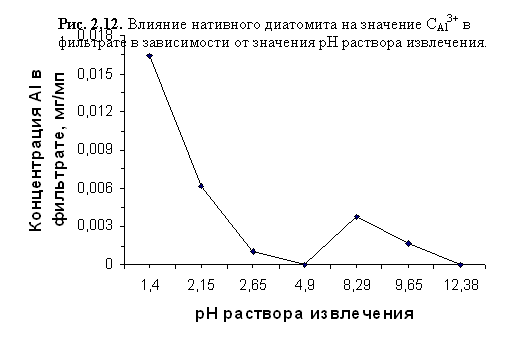 |
Резкое уменьшение концентрации исследуемого иона в фильтратах при рНисх<4,9 связано с тем, что его адсорбция на обменных позициях глинистых минералов и поверхности аморфного кремнезёма происходит быстрее, чем трансформация поверхностных слоёв кристаллической решётки алюмосиликатов, так как требует меньших затрат энергии. Адсорбировавшись на поверхности кристаллитов, ионы Al3+ затрудняют проникновение протонов внутрь, защищая решётку от разрушения. В кислой среде происходит наложение процессов поглощения Al3+ диатомитом и выщелачивания алюминия из его глинистой составляющей.
Ульрихом [48, 708] было показано, что при рН 4,2-5,0 вытеснение Al из кристаллических решёток минералов сопровождается образованием полимерных аквагидроксокомплексов алюминия, занимающих их обменные позиции. Можно предположить, что этим объясняется снижение поглощения диатомитом ионов Al3+ из раствора при рНисх 4,90-8,29. К тому же подщелачивание раствора извлечения способствует активизации гидролиза, а образующиеся в растворе катионы Al(OH)x3-x нельзя определить по выбранной нами методике. При более щелочной реакции среды весь алюминий раствора переходит в форму комплексных ионов переменной основности и активно поглощается порошком диатомита.
Выводы
В результате проведённых исследований можно сделать следующие выводы об особенностях поведения алюминия и железа инзенского диатомита в моделируемых условиях внешней среды:
1. Прокаливание диатомита при 850°С в течение 4 часов приводит к разрушению входящих в его состав слоистых алюмосиликатов и частично иммобилизует полуторные окислы.
2. В кислой среде порошок диатомита становится источником подвижных форм алюминия и железа, из прокалённого при 850°С диатомита выход исследуемых элементов в раствор происходит при более низком значении его рН.
3. Диатомит обладает буферным действием в широком диапазоне значений рН (1-12,4), при кислой реакции среды оно более выражено, чем при щелочной.
4. Нативный диатомит способен поглощать ионы Al3+ из раствора хлористого алюминия, при кислом рН падение концентрации ионов происходит только за счёт адсорбции на отрицательно заряженных поверхностях, в щелочной среде процесс осложняется гидролизом соли и поглощением аквагидроксокомплексов алюминия.
5.
6. При рН растворах извлечения менее 5,72 нативный диатомит становится источником подвижного алюминия; в сильнокислой реакции среды (рН<4,0-4,5) его выход в раствор резко возрастает; из прокалённого при при 850°С диатомита выход алюминия происходит при более кислой реакции среды (рН<4,8).
7. Выщелачивание железа из породы имеет место при более низком значении рН (<3,32) не только за счёт глинистых
Приложение
Каталог разведанных месторождений диатомита Ульяновской области.
