Применение диатомита
 |
 |
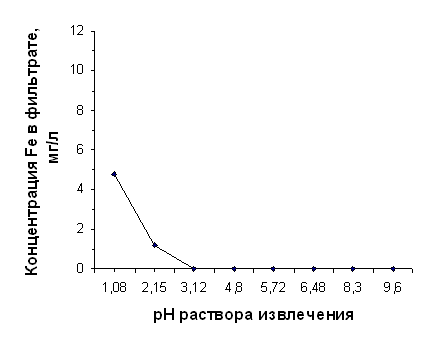
Зависимость выхода железа от значения рН раствора извлечения для диатомита, прокалённого при 850°С
|
рН исх | 1,08 | 2,15 | 3,12 | 4,80 | 5,72 | 6,48 | 8,30 | 9,60 | |||
| 4,74 | 1,18 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 |
 |
В диатомите железо заключено в кристаллической решётке алюмосиликатов и частично присутствует в виде свободных окислов. Силикатное железо появляется в кислом растворе вследствие разрушения глинистых минералов по вышеописанному механизму. При замещении водородом обменных катионов протоны взаимодействуют с дефектными тетраэдрами, в которых Si4+ замещён на Fe3+, или октаэдрами c Fe3+ вместо Al3+. Связи Fe—O или Fe—OH протонируются, железо занимает обменные позиции и приобретает способность переходить в раствор. Но свободные окислы железа начинают растворяться при более высоком значении рНисх, так как разрушение ионных и ионно-ковалентных связей кристаллической решётки требует большего количества энергии.
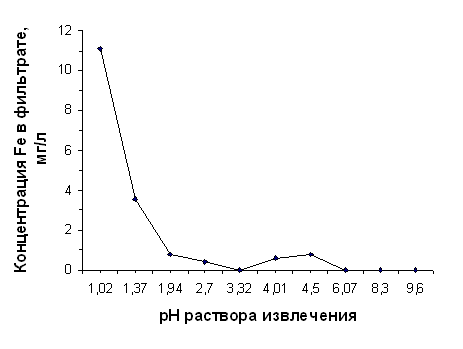
Способность ионов Fe3+ гидролизоваться выше, чем у ионов Al3+, поэтому можно предположить, что при 3,32 <рН<5,72 на процесс выхода железа из нативного диатомита накладывался процесс образования Fe3+ гидроксокомплексов Fe(OH)2+, Fe(OH)2+, Fe(OH)°, который не полностью подавлялся присутствием ионов Сl‾ и Н+ в растворе извлечения. В таком виде железо не определяется сульфосалициловым методом. Этим можно объяснить «горб» на графике, представленном на рисунке 2.3.
Ульрихом [48, 709] было показано, что при рН<3,2 в почве начинается растворение минералов гидроокисей и окисей железа, сопровождающееся появлением ионов Fe3+ в почвенном растворе. По данным наших исследований, резкое повышение выщелачивания железа из диатомита отмечалось при рН<3,32 (от нулевого выхода при рН 3,32 до концентрации Fe3+ в фильтрате 11,07 мг/л при рН 1,02), что в общем соответствуют закономерностям перехода железа в подвижное состояние с понижением рН среды, подробно описанными Л. А. Воробьёвой [28, 315].
Оранжевый цвет термоактивированного диатомита объясняется переходом всего содержащегося в нём железа в форму оксида железа (III). Он отчасти включается в состав силикатной плёнки на поверхности частиц, поэтому в фильтратах при рНисх>3.12 не отмечается присутствие ионов Fe3+. Но в сильнокислой среде (рН<3) Fe2O3 хорошо растворим, и на концентрацию Fe3+ в растворе извлечения не влияют сопутствующие реакции образования гидроксокомплексов. Поэтому в данных условиях из диатомита, прокалённого при 850°С, также интенсивно выщелачивается железо.
Относительный выход алюминия и железа из диатомита.
На основе данных о валовом химическом составе и выходе алюминия и железа из диатомита в зависимости от рН раствора извлечения, были рассчитаны показатели относительного выхода этих элементов (в пересчёте на 100 г породы и в массовых процентах) для нативного диатомита и диатомита, прокалённого при 850°С. Результаты приведены в таблицах 2.10, 2.11, 2.12 и 2.13 и на графиках, представленных на рисунках 2.5, 2.6, 2.7 и 2.8.
Таблица 2.10
Относительный выход алюминия из нативного диатомита в зависимости от значения рН раствора извлечения
|
рН исх | 1,02 | 1,94 | 2,70 | 4,01 | 5,72 | 6,07 | 8,30 | 9,60 | |
|
CAl3+, мг/см3 | 0,0175 | 0,0129 | 0,0033 | 0,0011 | 0,0000 | 0,0000 | 0,0000 | 0,0000 | |
| Относительный выход Al, |
мг/100 г породы | 9,397 | 6,708 | 1,650 | 0,591 | 0,000 | 0,000 | 0,000 | 0,000 |
|
масс. % | 0,332 | 0,237 | 0,058 | 0,021 | 0,000 | 0,000 | 0,000 | 0,000 | |