Применение диатомита
 |
 |
Таблица 2.7
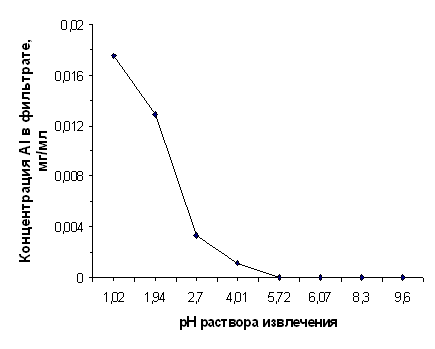
Зависимость выхода алюминия от рН раствора извлечения для диатомита, прокалённого при 850°С
|
рН исх | 1,08 | 2,15 | 3,12 | 4,80 | 5,72 | 6,48 | 8,30 | 9,60 | |||
| 0,0186 | 0,0109 | 0,0038 | 0,0000 | 0,0000 | 0,0000 | 0,0000 | 0,0000 |
 |
В породе Al2O3 находится в связанном состоянии в составе кристаллической решётки глинистых минералов – гидрослюды и монтмориллонита.
Многочисленные исследования механизма взаимодействия слоистых алюмосиликатов с протонами показывают, что многие из них практически невозможно получить в моноионной Н+-форме, так как они самопроизвольно и немедленно становятся насыщенными Al [36, 98], то есть в них он занимает обменные позиции и способен переходить в раствор.
Д. С. Орлов, Т. А. Соколова и др. объясняют этот факт разрушением кристаллической решётки минералов в ходе реакций протонирования (см. рис. 1.8.). При действии на кристаллиты кислых водных растворов (в природе или лаборатории) катионы оснований Mex+ вытесняются и замещаются на ионы H+. В первую очередь протоны реагируют с гидроксильными группами октаэдрического слоя, находящимися на её боковых сколах. Но, имея достаточно малый радиус, они сравнительно легко мигрируют внутрь кристаллической решётки, а также могут взаимодействовать с ОН-группами, расположенными «на дне» гексагональных пустот тетраэдрической сетки, если глинистый минерал характеризуется подвижной решёткой. В гидрослюде калий с трудом вытесняется из своих обменных позиций, связь между пакетами достаточно прочная, поэтому при слабо- и среднекислом рН раствора взаимодействие с протонами ограничено поверхностными слоями кристаллической решётки.
В результате таких реакций ион Al3+, занимавший центральную позицию в алюмогидроксильном октаэдре, превращается в ион Al(OH)2+ или Al(OH)2+. Структура октаэдра нарушается, и ионы алюминия приобретают способность к обмену. Благодаря избытку ионов H+ и Cl‾ в растворах извлечения весь алюминий переходит в форму простого иона Al3+, и катионы K+ вытесняют его в раствор.
Лабораторные эксперименты и полевые исследования показали, что насыщение почвенного поглотительного комплекса обменным алюминием и развитие процесса подзолообразования связаны с разрушением алюмосиликатов даже при слабокислой реакции почвенного раствора [28, 140]. В результате истощения буферной ёмкости почв и снижения рН до величины менее 4,2 количество подвижного алюминия резко возрастает [4, 23], в том числе и за счёт вышеописанных процессов. Поскольку наши исследования показали значительный рост CAl3+ в фильтратах при 1<рНисх<4,01 (cм. Таблицу 2.6), то эти данные подтверждают предположение о том, что в сильнокислой почве алюмосиликатная составляющая диатомита может стать дополнительным источником обменного алюминия в почвенном растворе. При рН>5,72 не отмечалось его выщелачивания из породы, что также согласуется с литературными данными о поведении алюминия в почве.
При прокаливании диатомита происходит частичное разрушение алюмосиликатов и переход Al2O3 в неактивное состояние: он включается в состав силикатной плёнки на поверхности частиц, устойчивой к воздействию протонов [20, 45]. Поэтому выход алюминия из термоактивированного диатомита отмечался при меньшем, чем для нативного диатомита рН.
Выход железа из диатомита в зависимости от значения рН раствора извлечения
А) Выход железа из нативного диатомита также отмечался только при кислой реакции раствора извлечения (1<рНисх<5,72):
· рНисх 3,32 – 5,72 – было зафиксировано появление ионов Fe3+ в фильтрате (при рН 4,50 их концентрация максимальна на данном интервале рН);
· рНисх 3,32 – выхода железа из диатомита не отмечалось (CFe3+в фильтрате равна 0);
· при рНисх <3,32 вновь начался выход железа из диатомита, с уменьшением значения рН он постоянно возрастал.
В) Порошок диатомита, прокалённого при 850°C, становится источником железа при меньших значениях рН раствора извлечения (<3,12). В более щелочной среде присутствие в фильтратах ионов Fe3+ не отмечалось.
Данные, отражающие зависимость CFe3+ в фильтрате от рН раствора извлечения, приведены в таблицах 2. 8 и 2.9 и отражены на графиках, представленных на рисунках 2.3 и 2.4.
Таблица 2.8
Зависимость выхода железа от значения рН раствора извлечения для нативного диатомита
|
рН исх | 1,02 | 1,37 | 1,94 | 2,70 | 3,32 | 4,01 | 4,50 | 6,07 | 8,30 | 9,60 |
|
CFel3+, мг/л | 11,07 | 3,56 | 0,79 | 0,40 | 0,00 | 0,59 | 0,79 | 0,00 | 0,00 | 0,00 |

