Липиды центральной нервной системы и структура клеточных мембран
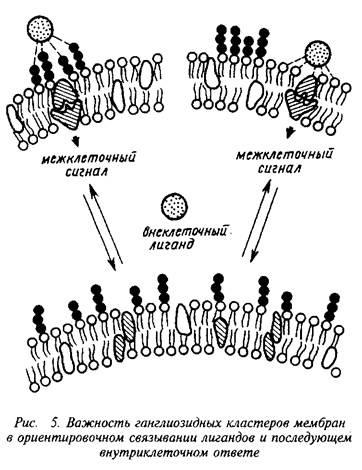
8.3 Ганглиозиды и передача информации через мембраны
Ганглиозиды участвуют в модулировании рецепторных функций.
Диапазон рецепторных свойств ганглиозидов широк: они связывают токсины, вирусы, медиаторы и гормоны. Есть данные о том, что ганглиозиды потенциируют действие нейроро-стового фактора и участвуют в рецепции интерферона.
Из всего множества индивидуальных ганглиозидов только для девяти строго доказана специфичность связывания. Это прежде всего моносиалоганглиозид GMI, который высокоспецифично взаимодействует с холерным токсином, дофамином, тиротропином; а также пента-, тетра-, три- и дисиалоганглиозиды – компоненты рецепторного комплекса для токсинов, вирусов, гормонов, и дисиалоганглиозид GD3, который в эквимолекулярных соотношениях соединяется с серотонином.
Сродство ганглиозидов головного мозга к различным лигаидам
|
Лиганлы |
Ганглиозид, обладаюший преимущественным сродством к лиганлу |
|
Холерный токсин |
GMi' GDlb |
|
Столбнячный токсин |
GQIb> GDlb* GTlb |
|
Ботулинический токсин |
GTIb |
|
Токсин Е. coli |
GM1 |
|
Вирус Сендай |
GPi> GQlb> GTla |
|
Вирус гриппа |
GTlb> GDlb |
|
Дофамин |
GM1 |
|
Серотонин |
GD3 |
|
Интерферон |
GM2> GT1 |
|
Тиротропин |
GTlb> GDlb> GM1 |
|
Лютеотропин |
GTlb> GDib |
|
Гонадотропин |
GTlb |
|
Фибронектин |
GTh GDlo |
Взаимодействие ганглиозидов с холерным токсином привлекает особое внимание, что обусловлено широким использованием его для изучения механизмов действия нейрорецепторов. В настоящее время наиболее изучен механизм взаимодействия холерного токсина с моносиалоганглиозидом GM1. Некоторое функциональное значение в опосредовании действия холерного токсина, кроме G^, имеет дисиалоганглиозид GDIfcr Установлено, что взаимодействие между ними модифицирует структуру холерного токсина и нарушает бислой мембраны. Олигосахаридная часть моносиалоганглиозида GM1 связывается с узнающей молекулой холерного токсина – протомером В, что вызывает увеличение локальной плотности ганглиозидов, их ми-целлообразование. Мицеллы ганглиозидов взаимодействуют с регуляторной единицей холерного токсина – протомером А. Этот протомер А обладает АДФ-рибозилирующей активностью. В результате АДФ-рибозилирования компонентов некоторых из так называемых медленных рецепторов происходит активация аде-нилатциклазы.
Мицеллы ганглиозидов способствуют погружению нротоме-ра А в липидную фазу и транслокации протомера А внутрь клетки. Чем выше концентрация ганглиозидов и мицеллообразова-ние, тем выше рибозилтрансферазная активность протомера А. Ганглиозиды в немицеллярной форме не способны «погрузить» протомер А в мембрану.
■ Мицеллообразование ганглиозидов способствует, таким образом, реорганизации липидного слоя, причем это свойство зависит от структуры комплекса токсин-ганглиозид.
8.4 Участие ганглиозидов в дифференциации клеток
Была предложена модель клеточного цикла, в которой кроме стадии покоя G0, неустойчивой и регулируемой циклическими нуклеотидами, постулируется стадия D-дифференциации, контролируемая ганглиозидами. По мере формирования ней-рон-нейрональных взаимодействий меняется структура и количество ганглиозидов и увеличивается число высокоаффинных контактов.
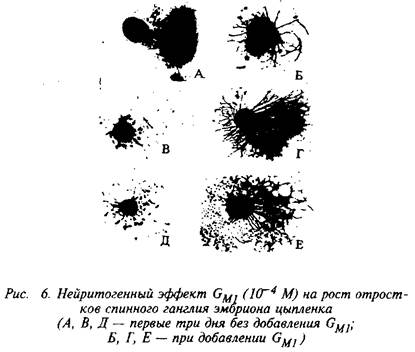
Участвуя в дифференциации клеток, ганглиозиды увеличивают время выживания клеток и вызывают морфологические изменения клеток, проявляя нейритогенный эффект. Нейритогенный эффект экзогенных ганглиозидов обнаружен в культурах клеточных линий нейронального и хромаффинного происхождения, в симпатических и парасимпатических ганглиях и в нервно-мышечных препаратах.
На рис. 6 представлен нейритогенный эффект моносиалоганглиозида GMI в концентрации 10~М на рост отростков спи-нального ганглия эмбриона цыпленка. Экзогенные ганглиозиды оказывают влияние на протяженность отростков, их число на клетку и на разветвленность отростков. Интересно, что моносиалоганглиозид GM1 вызывает только увеличение длины аксонов, а три- и тетрасиалоганглиозиды в тех же концентрациях усиливают спрутинг и арборизацию.
8.5 Терапевтические эффекты ганглиозидов
Ганглиозиды in vivo обладают уникальными свойствами: при введении в организм подкожно, внутримышечно или интраперитонеально они относительно длительное время сохраняются в кровяном русле, лишены токсичности, в небольших количествах проникают через гемато-энцефалический барьер и активно встраиваются в нейрональные мембраны. Они способствуют репарации поврежденных аксонов, обладают выраженными терапевтическими эффектами при травмах головного и спинного мозга.
В настоящее время наиболее изучена молекулярная и биологическая роль в этих процессах моносиалоганглиозида GM1, который при введении in vivo:
а) восстанавливает нейрохимические параметры дофаминер-гических нейронов после нарушения нигростриатной системы, усиливает захват дофамина и активность ирозингидроксилазы;
б) восстанавливает нейрохимические характеристики при частичной холинергической и глутаматергической деафферен-тации гиппокампа, увеличивает активность холинацетилтрансферазы и ацетилхолинэстеразы;
в) восстанавливает высокоаффинный захват холина в коре больших полушарий после нарушений ядер переднего мозга;
г) нормализует дисбаланс между активностью дофамин- и серотонинергических нейронов, вызванный введением апомор-фина;
д) оказывает рост-стимулирующий эффект и защитное действие против вторичной дегенерации серотонин- и норадре-нергических нейронов, вызванной нейротоксинами;
е) уменьшает церебральный отек и восстанавливает ионный баланс после травмы;
ж) способствует регенерации зрительного нерва после перерезки.
С другой стороны, введение антител к GM] вызывает у развивающихся животных нарушение дендритной арборизации и поведения, ухудшение обучаемости, появление эпилептиформ-ной активности.
