Страница
8
Цикл Кребса, глиоксилатный и пентозофосфатный пути функционируют только в условиях достаточного количества кислорода. В то же время 02 непосредственно не участвует в реакциях этих циклов. Точно так же в перечисленных циклах не синтезируется АТФ (за исключением АТФ, образующегося в цикле Кребса в результате субстратного фосфорилирования на уровне сукцинил-СоА).
Кислород необходим для заключительного этапа дыхательного процесса, связанного с окислением восстановленных коферментов НАДH и ФАДH2 в дыхательной электронтранспортной цепи (ЭТЦ) митохондрий. С переносом электронов по ЭТЦ сопряжен и синтез АТФ.
Дыхательная ЭТЦ, локализованная во внутренней мембране митохондрий, служит для передачи электронов от восстановленных субстратов на кислород, что сопровождается трансмембранным переносом ионов Н + . Таким образом, ЭТЦ митохондрий (как и тилакоидов) выполняет функцию окислительно-восстановительнои Н -помпы. ,
Б. Чане и др. (США) в 50-х годах, используя значения окислительно-восстановительных потенциалов известных в то время переносчиков е-, спектрофотометрические данные о временной последовательности их восстановления и результаты ингибиторного анализа, расположили компоненты ЭТЦ митохондрий в следующем порядке:
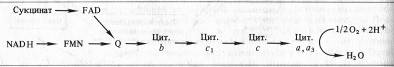
Пара электронов от НАДH или сукцината передается по ЭТЦ до кислорода, который, восстанавливаясь и присоединяя два протона, образует воду.
Д. Грин (1961) пришел к выводу, что все переносчики электронов в митохондриальной мембране сгруппированы в четыре комплексу, что было подтверждёно дальнейшими исследованиями.
Согласно современным данным дыхательная цепь митохондрий включает в себя четыре основных мультиэнзимных комплекса и два небольших по молекулярной массе компонента — убихинон и цитохром с
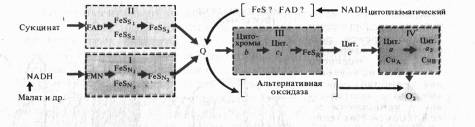
Рис.7. Дыхательная электронтранспортная цепь растительных митохондрий
Комплекс I осуществляет перенос электронов от НАДH к убихинону Q. Его субстратом служат молекулы вдутримитохондриального НАДH, восстанавливающиеся в цикле Кребса. Всостав комплекса входит флавиновая ФМН-зависимая НАДH: убихи- нон-оксидоредуктаза, содержащая три железосерных центра (FeSN1-3). При встраивании в искусственную фосфолипидную мембрану этот комплекс функционирует как протонная помпа.
Комплекс II катализирует окисление сукцината убихиноном. Эту функцию осуществляют флавиновая (ФАД-зависимая) сукцинат : убихинон-оксидоредуктаза, в состав которой также входят три железосерных центра (Fes1_3).
Koмплекс III переносит электроны от восстановленного убихинона к цитохрому с, т. е. функционирует как убихинол: цитохром Т-оксидредуктаза. В своем составе он содержит цитохромыb556 иb560, цитохром с, и железосерный белок Риске. По структуре и функции этот комплекс сходен с цитохромным комплексомb6— f тилакоидов хлоропластов. В присутствии убихинона комплекс III осуществляет активный трансмембранный перенос протонов.
В терминальном комплексе IV электроны переносятся от цитохромас к кислороду. _т. е. этот комплекс является цитохромом с: кислород-оксидоредуктазой (цитохромоксидазой). В его состав входят четыре редокс-компонента: цитохромы а и а3 и два атома меди. Цитохром а3 и Сив способны взаимодействовать с 02, на который передаются электроны с цитохрома а — СиА. Транспорт электронов через комплекс IV сопряжен с активным транспортом ионов Н +.
В последние годы в результате изучения пространственного расположения компонентов ЭТЦ во внутренней мембране митохондрии показано что комплексы I, III и IV пересекают мембрану. На внутренней стороне мембраны, обращенной к матриксу, два электрона и два протона от НАДH поступают на флавинмононуклеотид комплекса I.
Электроны передаются на FeS-центры. Пара электронов от FeS-центров захватывается двумя молекулами окисленного убихинона, которые принимают два иона Н + , образуя семихиноны (2QH) и диффундируя к комплексу III. На эти семихиноны поступает еще пара электронов от цитохрома Ь560 комплекса III, что делает возможной реакцию семихинонов с еще двумя протонами из мАТФикса с образованием 2QH2. Полностью восстановленный убихинон (убихинол) отдает 2е~ цитохрому Ь556 и 2е~ FeSR — цитохрому с,. В результате освобождаются четыре иона Н+, выходящие в межмембранное пространство митохондрии. Окисленные молекулы убихинона вновь диффундируют к комплексу I и готовы принимать от него (или от комплекса II) новые электроны и протоны. Таким образом, цитохромы Ь служат донорами двух электронов для переноса двух дополнительных протонов через липидную фазу мембраны на каждые два электрона, поступающие из комплекса I.
Водорастворимый цитохром с на наружной стороне мембраны, получив 2е~ от FeSR — цитохрома ciy передает их на цитохром а — Сид комплекса IV. Цитохром а3 — Сив, связывая кислород, переносит на него эти электроны, в результате чего с участием двух протонов образуется вода. Как уже отмечалось, цитохромоксидазный комплекс способен также переносить ионы Н+ через митохондриальную мембрану.
Таким образом, из матрикса митохондрии при транспорте каждой пары электронов от НАДH к 1/2 02 в трех участках ЭТЦ (комплексы I, III, IV) через мембрану наружу переносятся по крайней мере шесть протонов. Как будет показано далее, именно в этих трех участках окислительные процессы в ЭТЦ сопрягаются с синтезом АТФ. Передача 2е~ от сукцината на убихинон в комплексе II не сопровождается трансмембранным переносом протонов. Это приводит к тому, что при использовании сукцината в качестве дыхательного субстрата в ЭТЦ остаются лишь два участка, в которых функционирует протонная помпа.
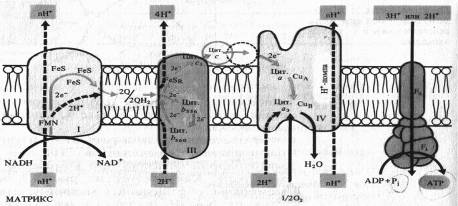
Рис. 8. Предполагаемое расположение компонентов цепи переноса электронов во внутренней мембране митохондрий в соответствии с хемиосинтетической теорией Митчелла
Особенностью растительных митохондрий (отличающей их от митохондрий животных) является способность окислять экзогенный НАДH, т. е. НАДH, поступающий из цитоплазмы. Это окисление осуществляется по крайней мере двумя флавиновыми НАДH-дегидрогеназами, из которых одна локализована на наружной стороне внутренней мембраны митохондрий, а другая — в их наружной мембране. Первая из них передает электроны в ЭТЦ митохондрий на убихинон, а вторая — на цитохром с. Для функционирования НАДH- дегидрогенэзы на наружной стороне внутренней мембраны необходимо присутствие кальция.
Другое существенное отличие растительных митохондрий состоит в том, что во внутренней мембране помимо основного (цитохромного) пути переноса электронов имеется альтернативный путь переноса е~, устойчивый к действию цианида.
Перенос электронов от НАДH к молекулярному кислороду через ЭТЦ митохондрий сопровождается потерей свободной энергии. Какова судьба этой энергии? Еще в 1931 г. В. А. Энгельгардт показал, что при аэробном дыхании накапливается АТФ. Он первый высказал идею о сопряжении между фосфорилированием АДФ и аэробным дыханием. В 1937—1939 гг. биохимики В. А. Белицер в СССР и Г. Калькар в США установили, что при окислении промежуточных продуктов цикла Кребса, в частности янтарной и лимонной кислот, суспензиями животных тканей исчезает неорганический фосфат и образуется АТФ. В анаэробных условиях или при подавлении дыхания цианидом такого фосфорилирования не происходит. Процесс фосфорилирования АДФ с образованием АТФ, сопряженный с переносом электронов по ЭТЦ митохондрий, получил название окислительного фосфорилирования.
