Механизмы выживания бактерий в окружающей среде
Радиорезистентность может определяться уровнем каталазной активности в. клетке. Было показано, что для некоторых бактерий с повышенной радиорезистентностью характерно высокое содержание каталазы.
С возрастанием радиорезистентности увеличивается длина клеток: значительная часть клеток наиболее резистентных штаммов была в 30—40 раз длиннее нормальных. У клеток этих штаммов наблюдалось также своеобразное явление почкования. У резистентных штаммов, упомянутых выше, удлинение клеток было устойчивым признаком, наблюдавшимся в течение трех лет.
К важным факторам, от которых зависит реакция той или иной клеточной системы на любой физический или химический агент, относится состав клеточной стенки. В случае химических мутагенов структура клеточной стенки может определять ее проницаемость, влияя, таким образом, на чувствительность клетки к данному агенту. Хотя структура клеточной стенки не оказывает влияния на проникающую способность ионизирующего излучения, она тем не менее может иметь значение для радиорезистентности микроба. Например, вполне вероятно, что какой-либо связанный с мембраной ферментный комплекс, освобождающийся или активируемый под действием радиации, играет определенную роль в системе (системах) репарации или обусловливает конечную инактивацию клетки. Ионизирующее излучение вызывает освобождение связанной с клеточной поверхностью экзонуклеазы у М. radiodurans. При облучении в дозе 400 крад, сублетальной для этого организма, в клетках остается только 10% фермента, причем степень освобождения фермента зависит от дозы облучения.
Микробы-сапрофиты более устойчивы у световому излучению в сравнении с патогенными. Это объясняется тем, что они чаще подвергаются действию прямых солнечных лучей, поэтому являются более адаптированными (Радчук Н.А., Дунаев Г.В., 1991).
Увеличение содержания ДНК в клетке служит одним из факторов ее радиорезистентности. Это может быть обусловлено либо увеличением числа нуклеоидов в клетке, либо ее полиплоидностью. Нитевидная форма резистентных клеток Е. coli позволяет предполагать, что в них реализуется первый механизм. Но содержание ДНК в клетках этих штаммов практически не отличается от такового в клетках дикого типа.
Определение содержания GC-nap в ДНК восьми видов бактерий показало, что существует обратная зависимость между GC-содержанием и резистентностью клеток к рентгеновским лучам. В то же время между GC-содержанием и резистентностью к УФ-облучению наблюдается прямая зависимость. Такая корреляция утрачивает какой бы то ни было смысл в случае М. radiodurans, резистентного к обоим типам излучения; однако она может иметь некоторое значение при отсутствии у бактерий эффективных систем репарации. Действительно, ДНК М. radiodurans характеризуется тем же нуклеотидным составом, что и ДНК штаммов Pseudomonas, исключительно чувствительных к ионизирующей радиации (Покровский В.И., 1999).
6.1.1 Механизмы репарации ДНК
В основе радиорезистентности бактерий лежат разнообразные внутриклеточные процессы, участвующие в репарации поврежденной ДНК. Большую ценность для исследования этих процессов представляет наличие хорошо охарактеризованных мутантных штаммов, радиационная чувствительность которых варьирует в чрезвычайно широких пределах.
При помощи генетических скрещиваний были получены двойные и тройные мутанты дрожжей, у которых репаративная активность полностью отсутствует. Сравнительное исследование штамма дикого типа и сверхчувствительных двойных и тройных мутантов S. сеrevisiae показало, что если нормальный штамм довольно легко переносит образование в ДНК почти 16 000 димеров (37% выживания), то двойные и тройные мутанты остаются резистентными в присутствии не более 50 и 1 димера соответственно. Пониженная резистентность таких двойных и тройных мутантов служит убедительным свидетельством в пользу существования различных путей репарации радиационных повреждений.
В зависимости от того, участвует ли видимый свет в модификации повреждений ДНК, репарацию можно подразделить на световую и темновую. Конкретно под световой репарацией понимается феномен фотореактивации, впервые описанный у актиномицетов. Механизм фотореактивации действует только на пиримидиновые димеры. В этом процессе участвует фермент фотореактивации, который связывается с димерами. Образующийся фермент-субстратный комплекс активируется видимым светом, что приводит к мономеризации димеров in situ. Таким образом, летальный эффект УФ-облучения существенно снижается, если облученные клетки подвергаются затем воздействию видимого света с длинами волн от 360 до 420 нм (см. рис. 6.1).
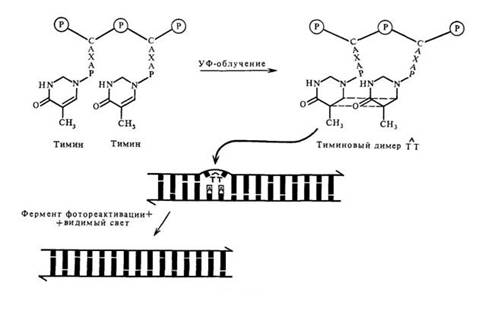
Рис. 6.1 Световая репарация ДНК
Фотореактивация служит мощным инструментом исследования летальных и мутационных повреждений, так как их репарация под влиянием света может быть использована в качестве критерия для решения вопроса о том, обусловлена ли инактивация ДНК образованием пиримидиновых димеров.
К другому типу реактивации клеток видимым светом относится его защитное действие. В этом случае увеличение выживаемости клеток наблюдается при освещении их видимым светом перед УФ-облучением. Этот феномен объясняют тем, что видимый свет индуцирует задержку клеточного деления. В результате такой задержки остается больше времени для репарации повреждений, вызываемых УФ-облучением (см. рис. 6.2).
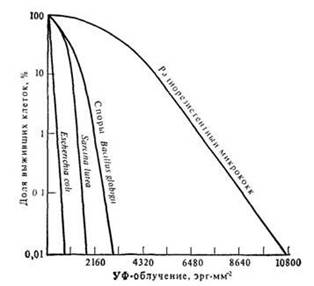
Рис. 6.2 Зависимость выживания клеток бактерий от величины облучения
Под «темновой репарацией» понимают репарацию без участия света. В настоящее время известны две системы такого типа: эксцизионная репарация и пострепликативная рекомбинационная репарация. Репарация первого типа требует присутствия ферментов, которые узнают нарушения структуры ДНК, удаляют затронутые участки, замещая их нормальными нуклеотидными последовательностями, и, наконец, восстанавливают первоначальную структуру ДНК, замыкая полинуклеотидную цепь (см. рис. 6.3).
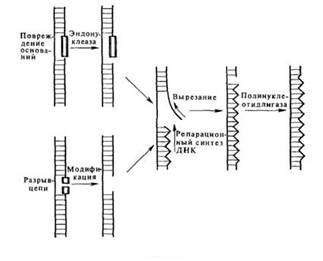
Рис. 6.3Темновая репарация ДНК
Действие разнообразных инактивирующих агентов на клетки может приводить к возникновению в ДНК целого ряда различных повреждений. Детальное изучение системы эксцизионной репарации стало возможным благодаря наличию радиационно-чувствительных мутантов, с помощью которых удалось выделить и охарактеризовать специфические ферменты, принимающие участие в разных стадиях этого процесса. У Е. coli имеется, по крайней мере, четыре таких этапа. На первом этапе происходит разрыв цепи ДНК вблизи повреждения под действием эндонуклеазы, узнающей нарушения структуры ДНК. Такая УФ-специфическая эндонуклеаза была выделена из Micrococcus luteus и Е. coli. За разрывом цепи ДНК следует удаление пиримидиновых димеров, осуществляемое экзонуклеазой. Удаление димеров сопровождается дополнительной деградацией ДНК с образованием брешей, размеры которых варьируют от 20 до 400 нуклеотидов. Затем бреши заполняются с помощью ДНК-полимеразы, использующей в качестве матрицы интактную комплементарную цепь ДНК. Заключительный шаг в этой последовательности событии состоит в восстановлении целостности полинуклеотидной цепи в результате сшивания разрыва лигазой.
