Клеточная биотехнология
В работах М.И.Соболевой и И.В.Логинова была сделана попытка определить зависимость морфогенной способности каллусов от различных факторов. По их мнению, тотипотентность и пролиферация тесно связаны единым молекулярным механизмом, выключение или нарушение которого приводит в культуре in vitro к формированию неморфогенного каллуса. Исследование комплексного показателя «размер-прирост биомассы» каллусов позволил заключить, что морфогенные каллусы увеличивают свою биомассу за счёт активной пролиферации, чем за счёт активного накопления сухого вещества. Увеличение биомассы и размера за счёт оводнения клеток в сочетание с их растяжением также маловероятно, так как в этом случае морфогенный каллус приобретал бы рыхлую оводнённую консистенцию, а он имел плотную глобулярную структуру. Прирост биомассы неморфогенного каллуса, по их мнению, в большей степени зависит от роста растяжением в сочетание с оводнением клеток. В ряде работ были выявлены морфологические различия клеток морфогенных и неморфогенных каллусов. Например, поверхность проэмбриональных клеточных комплексов морфогенного каллуса покрыта сетью экстраклеточного матрикса (ЭКМ), тогда как на поверхности клеток неморфогенного каллуса ЭКМ не наблюдается. Поверхностная сеть экстраклеточного матрикса представляет собой фибриллярную белковую структуру. ЭКМ – это структурный маркер характерный для проэмбриональных клеточных комплексов морфогенных культур и проэмбрио. Таким образом, наличие ЭКМ коррелирует с морфогенной способностью каллусов.
Суспензионная культура
Помимо культур каллусных клеток в научной практике довольно часто применяются культуры клеточных суспензий и культуры единичных (одиночных) клеток. Для начала рассмотрим суспензионную культуру.
Суспензию клеток можно получить из каллуса, поместив его в жидкую питательную среду с автоматическим перемешиванием. Суспензионную культуру получают непосредственно из ткани экспланта. Культура состоит из отдельных клеток и агрегатов, отделившихся от первично образованной каллусной ткани. Необходимым условием культивирования клеточных суспензий является постоянное перемешивание на качалке (90 – 120 об/мин), роллеров различного типа, или встряхивание среды. Если клеточная суспензия находится в неподвижном состоянии, то пролиферация суспензионных клеток приводит к образованию каллусной ткани. Также необходимыми условиями поддержания культуры является аэрация, оптимальные температуры (20-30оС), а также определенный объём и физиологическое состояние инокулюма (часть клеточной суспензии, используемая для переноса на свежую среду). Минимальный объём инокулюма, необходимый для роста культуры, зависит от вида объекта, фазы роста и состава культуральной среды. При слишком больших объёмах рост клеток в суспензии может ингибироваться из-за накопления токсичных продуктов метаболизма, либо из-за недостатка питательного субстрата.
Начальный момент получения суспензионной клеточной культуры является рандомическим событием. Это означает, что только клетки, которые по ряду причин способны к перестройке метаболизма и размножению с высоким коэффициентом в данных конкретных условиях суспензионного культивирования, образуют «хорошие» линии. Важными характеристиками иаких линий является высокая степень дезинтеграции (5-10 клеток в группе), морфологическая выравненность клеток. На рисунке показаны микрофотографии суспензионных клеток отвечающих этим критериям.
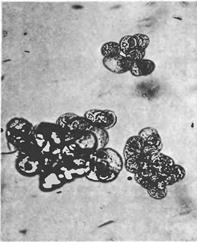
Морфологическая вариабельность клеток суспензионных культур не слишком высока: встречаются одиночные растянувшиеся клетки, содержащие огромную вакуоль и пристеночный слой цитоплазмы с крупным ядром; клетки меньшего размер, округлые или овальные, в той или иной степени вакуолизированные, с более плотной цитоплазмой, одиночные или образующие агрегаты.
Суспензии лучше образуются из рыхлого каллуса, получаемого на средах с 2,4-Д. Исключение из питательной среды ионов кальция облегчает суспензирование. Ещё больше облегчает этот процесс добавление в среду пектидазы, способной гидролизировать пектиновые связи в клеточной стенке.
Кривая роста клеток в суспензии, как и клетки каллусной культуры, имеет S--образную форму.
Выращивание клеточных суспензий в жидкой питательной среде имеет ряд преимуществ перед выращиванием каллусных тканей поверхностным способом. Здесь легче и более воспроизводимо влиять на метаболизм и рост клеточных популяций экзогенными факторами. Они удобнее для биохимических и молекулярно-биологических экспериментов – изучения индукции ферментов и связи их с событиями клеточного цикла, экспрессии и репрессии определённых генов, изолирования и характеристик мутантов.
Работы по культивированию и субкультивированию проводят в асептических условиях.
Первичную суспензию перед субкультивированием фильтруют через 1 — 2 слоя марли, нейлоновые или металлические сита, чтобы избавиться от крупных, плотных кусков каллусной ткани, остатков экспланта и очень крупных агрегатов. Фильтрование рекомендуется и в нескольких последующих субкультивированиях до приобретения клеточной суспензией желательных характеристик. Однако агрегированность суспензии зависит не только от характеристик начальной линии, но и от условий культивирования.
Способы выращивания, разработанные в микробиологии, применяются для глубинного культивирования растительных клеток. Используются закрытые или открытые системы в периодическом или проточном режимах. В закрытой системе при периодическом режиме выращивания клеточная масса (инокулюм) помещается в определенный объем среды. До конца выращивания система остается закрытой по всем параметрам, кроме газов. В закрытой культуре в систему периодически подается свежая питательная среда, а старая удаляется в том же объеме. Клетки при этом остаются в системе в течение всего цикла выращивания.
В открытые проточные культуры периодически (или непрерывно) поступает свежая питательная среда, однако отбирается не только старая среда, но и часть урожая клеточной массы. Регуляция этого процесса может осуществляться по принципу турбидостата или хемостата. В турбидостате подача свежей среды, и отбор суспензии происходят после достижения клеточной популяцией определенной заданной плотности. Сигнал на включение протока поступает от реле, связанного с оптической системой, определяющей плотность клеток. В хемостате скорость протока задается экспериментатором и от нее зависит скорость роста клеточной массы. Для этого питательная среда лимитируется по одному из наиболее важных для роста факторов, чаще всего по фосфору, азоту или сахару. Режим хемостата позволяет с помощью фиксированной скорости разбавления поддерживать константную скорость деления и плотность клеток в популяции.
Клеточные суспензии в биотехнологии используются для получения вторичных метаболитов, многие из которых являются ценными лекарственными препаратами, для промышленного выращивания клеточной биомассы и для клеточной селекции. Наряду с этим, суспензии клеток можно применять в качестве исходного материала для получения изолированных протопластов. Для промышленного получения продуктов вторичного синтеза из больших клеточных масс используют ферментеры большой емкости (от 20000 и более литров), в которых проводят непрерывное культивирование клеток. Суспензионные культуры могут быть не только источником ценных вторичных метаболитов, но в них выявлены также другте соединения, например, камптотецин, харрингтонин и другие антиканцерогены, пептиды (ингибитор протеаз, ингибитор фитовирусов) и др. Следует отметить, что деление клеток, приводящее к увеличению клеточной биомассы, и синтез вторичных метаболитов разобщены во времени. Синтез вторичных метаболитов достигает максимума в стационарной фазе роста.
