Влияние производных адамантана с различными характерами заместителей на индуцированную агрегацию тромбоцитов человека
г.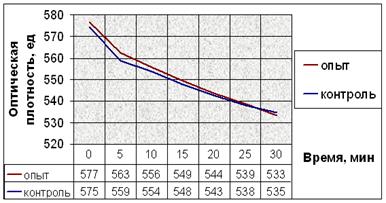
д.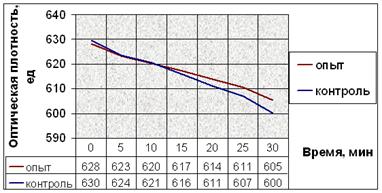
Рис. 11. Динамика снижения оптической плотности проб при АДФ-индуцируемой агрегации тромбоцитов человека. (а) В опытные пробы добавляли соединение № 2. (б) В опытные пробы добавляли соединение № 9. (в) В опытные пробы добавляли соединение № 12. (г) В опытные пробы добавляли соединение № 13. (д) В опытные пробы добавляли соединение № 14.
Заметим, что влияние исследуемых соединений на АДФ-индуцируемую агрегацию тромбоцитов наблюдается не сразу после их добавления в пробы (как в эксперименте с серотонином), а лишь после определённого латентного периода (рис. 11). Это значит, что соединения начинают влиять на рецепторы для АДФ только после внедрения в плазматическую мембрану, изменяя их сродство к лиганду.
Снижение оптической плотности в опытных пробах с соединением № 2 в течение первых 20 минут мало отличается от такового в контрольных, но за последующие 10 минут оно более интенсивно и достоверно отличается от контроля. После пяти минут экспозиции падение оптической плотности в пробах с добавлением вещества № 9 интенсивнее. Отличия динамики снижения оптической плотности опытных и контрольных проб в эксперименте с веществом № 12 также начинаются после пяти минут экспозиции. Интенсивность снижения оптической плотности в опытных пробах в эксперименте с веществом № 13 почти не отличается от таковой в контрольных. Соединение № 14 способствует замедлению падения оптической плотности опытных проб после 10 минут от начала агрегации (рис. 11).
Полученные данные говорят о том, что, скорее всего, производне № 2 и 13 изменяют сродство серотонина к рецепторам-ионным каналам, а производные № 9, 12 и 14 способны влиять на сродство лиганда к своим гликопротеиновым рецепторам (табл. 22).
К гликопротеиновым рецепторам, функционирующим посредством G-белков, относится большинство из множества всех рецепторов клеток (в данном случае тромбоцитов). Возникает вопрос о специфичности влияния исследуемых производных адамантана. Возможно, среди данных соединений присутствуют синергисты других агрегантов, также проводящих сигнал активации посредством ассоциации с гликопротеиновыми рецепторами. Действительно, предположение подтверждено экспериментом с добавлением веществ при индукции агрегации тромбоцитов адреналином: вещества № 9 и № 12 ускоряют проведение сигнала и через сопряжённые с G-белком адренорецепторы, а вещества № 2, 13 и 14 не способны модулировать функционирование тромбоцитарных адренорецепторов (табл. 23, рис. 12).
Таблица 23.
Влияние производных адамантана на адреналин-индуцированную агрегацию тромбоцитов человека in vitro
|
№ изучаемого соединения |
Интенсивность агрегации тромбоцитов, у. е. | |
|
Опыт, n=10 |
Контроль, n=6 | |
|
2 |
39,4±1,8 |
41,5±3,5 |
|
9 |
48,7±5,1* |
33,6±4,6 |
|
12 |
46,0±1,2*** |
30,3±3,2 |
|
13 |
40,5±3,4 |
40,2±4,0 |
|
14 |
27,4±1,8 |
30,2±1,1 |
П р и м е ч а н и е: уровни достоверности результатов ٭- р<0,05; ٭٭٭- p<0,001 к контролю.
Динамика снижения оптической плотности в пробах с добавлением соединения № 2 не отличается от таковой в контрольных (так же и в эксперименте с соединениями № 13 и № 14). Значит, эти соединения не способны влиять на проведение сигнала активации через адренорецепторы. Добавление в опытные пробы соединения № 9 значительно ускоряло падение их оптической плотности по сравнению с контролем, то же наблюдалось и при добавлении соединения № 12.
Совершенно очевидно, что под влиянием соединений № 9 и 12 увеличивается эффективность того этапа (или нескольких этапов) функционирования гликопротеиновых рецепторов, который является общим для всех типов этих рецепторов, не зависимо от их специфичности (рис. 12, б, в).
Таким образом, доказанная предыдущими исследованиями [13] биологическая активность аминопиридиновых производных адамантана подтверждается и в нашем эксперименте: N-(1-адамантилацетил)-4-аминопиридин (№ 9) значительно увеличивает сродство тромбоцитарных рецепторов ко всем используемым в эксперименте агрегантам (табл. 10, 22, 23). Причём это, скорее всего, свидетельствует о его способности к модуляции функционирования гликопротеиновых рецепторов. Модификация аминопиридинового заместителя в составе производного адамантана приводит к изменению его активности: 2-[N-(1-адамантоил)амино]-1-метилпиридиний иодид (№ 2) усиливает, видимо, сродство серотонина к своим рецепторам со свойствами ионных каналов, почти не влияя на сродство к гликопротеиновым рецепторам (табл. 3, 22, 23).
Исследованиями [55] показана способность объёмных заместителей, вносимых в молекулу адамантана, изменять сродство серотонина к своим рецепторам. Существуют также экспериментально подтверждённые данные о том, что введение в молекулу производного высоколипофильного радикала усиливает его взаимодействие с гидрофобными областями рецепторных молекул [27]. Эти данные подтверждаются и в нашем эксперименте: 4-адамантанкарбоксамидо-этилбензоат (№ 14) действительно имеет подобную активность (табл. 15, 22), способствуя замедлению проведения сигнала активации АДФ и серотонином. Причём некоторое блокирование проведения сигнала под действием 4-адамантанкарбоксамидо-этилбензоата наблюдается через 10 минут. На адреналин-индуцируемую агрегацию он почти не влияет, и причину этого явления ещё предстоит выяснить.
Аминокислотные производные адамантана – 3-(1-адамантанкарбоксамидо-этил)индол (№ 12) и N-(1-адамантоил)-D,L-гистидин (табл. 1, № 13), – тоже имеют интересную активность. N-(1-адамантоил)-D,L-гистидин, вероятно, антагонистически действует только на серотониновые ионные каналы тромбоцитов, а 3-(1-адамантанкарбоксамидо-этил)индол весьма эффективно ускоряет агрегацию тромбоцитов, индуцированную и серотонином, и АДФ, и адреналином (табл. 13, 22, 23), т. е. его активность направлена на рецепторы гликопротеинового типа. Вещество № 12 интересно ещё и тем, что его структура очень похожа на структуру самого серотонина (рис. 7). Несмотря на то, что вещество № 12, как и серотонин, является производным триптофана, оно не является его агонистом (табл. 21).
