Страница
7
2. Собственные исследования
2.1 Цель и задачи
Целью нашей работы была разработка методов профилактики и санитарного контроля технологических процессов при трансплантации эмбрионов у крупного рогатого скота.
Для достижения этой цели нами поставлены на разрешение следующие задачи:
1. Изучить бактериальную контаминацию половых путей телок-реципиентов в фолликулярную и лютеальную фазы полового цикла.
2. Изучить влияние антибактериальных препаратов на микрофлору половых путей после их санации непосредственно перед извлечением и пересадкой эмбрионов.
3. Провести сравнительную оценку антибактериальных препаратов для санации половых путей.
4. Испытать антибиотики для санации промывных буферных сред и отмывки эмбрионов.
5. Изучить влияние испытанных нами антибактериальных препаратов на жизнеспособность и приживляемость эмбрионов.
2.2 Материалы и методика исследований
Все исследования по данной работе проводились в лаборатории трансплантации эмбрионов сельскохозяйственных животных Харьковского биотехнологического центра Украинской академии аграрных наук и на пункте трансплантации эмбрионов опытного хозяйства «Кутузовка». Работа выполнялась в период с июля 2000 года по август 2001 года.
Пункт трансплантации эмбрионов крупного рогатого скота, построенный по типовому проекту, имеет манеж для санитарной обработки животных перед операцией, операционную, поисковую и стерильный бокс для первичной обработки эмбрионов, помещение для замораживания и хранения эмбрионов, моечную и др. В манеже и операционной расположены специальные фиксационные станки. Операционная, поисковая и стерильный бокс оборудованы бактерицидными лампами. Пункт оснащен необходимым лабораторным, технологическим оборудованием и лабораторной посудой.
Предметом исследования были коровы и телки черно-пестрой породы и полученные от них эмбрионы.
В опытном хозяйстве «Кутузовка» беспривязная система содержания на глубокой несменяемой подстилке.
Кормление животных проводили по общепринятым нормам. Рационы были сбалансированы по общей питательности, белку, фосфору, кальцию и витаминным добавкам.
Животные регулярно подвергались ветеринарно-профилактическим и санитарным обработкам, клинико-гинекологическим обследованиям, постоянно находились под ветеринарно-зоотехническим наблюдением.
Исследования проводили на коровах-донорах и телках-реципиентах с нормальным состоянием половых органов и цикличностью воспроизводительной функции. Опытная группа состояла из коров в возрасте 3–8 лет, с живой массой 500–600 кг и телок в возрасте 16–18 месяца, с живой массой 350–380 кг. В контрольную группу отбирали коров и телок методом пар-аналогов. В экспериментах использовано 25 коров-доноров и 60 телок – реципиентов. Для вызывания суперовуляции применяли препараты ФСГ.
Животные обрабатывались по 4-х дневной схеме ФСГ‑п производства фирм «Schering Corp» или» Burns Biotec» США и ФСГ-супер (Россия) в общей дозе 50 мг (Табл. 1).
Таблица 1. Схема гормональной обработки коров-доноров препаратом ФСГ‑п (50 мг) производства США
|
День эстрального цикла |
Название препарата |
Доза (мг) |
Общая доза | |
|
утро |
вечер | |||
|
10–12 |
ФСГ‑п |
7 |
7 |
14 |
|
11–13 |
ФСГ‑п |
6,5 |
6,5 |
13 |
|
12–14 |
ФСГ‑п |
6 |
6 |
12 |
|
Простогландин |
250 |
250 |
500 мкг | |
|
13–15 |
ФСГ‑п |
5,5 |
5,5 |
11 |
|
14–16 |
Охота и осеменение | |||
|
21–23 |
Нехирургическое извлечение эмбрионов | |||
Синхронизация полового цикла доноров и реципиентов осуществлялась инъекцией экстрофана.
Осеменение коров-доноров проводилось двукратно двойной дозой замороженно-оттаянной спермы с содержанием не менее 25 млн. активных спермиев (рис. 1). Из спермодозы готовили мазки для определения патологических форм спермиев. Мазки высушивали, фиксировали и окрашивали гематоксилином Караччи. Сперму, содержащую 18% и более патологических спермиев, выбраковывали, так как высокий процент патологических спермиев снижает оплодотворяющую способность спермы.
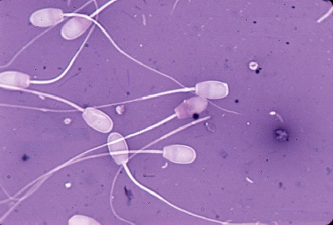
Рис. 1. Нормальные спермии быка
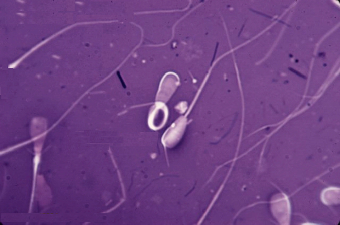
Рис. 2. Патологические формы спермиев
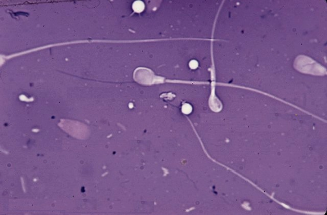
Рис. 3. Патологические формы спермиев
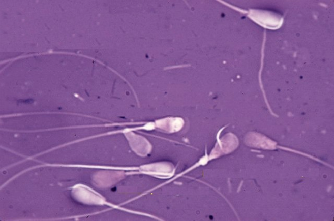
Рис. 4. Патологические формы спермиев
Для бактериологических исследований использовали мясо-пептонный агар (МПА) и мясо-пептонный бульон (МПБ), среду Китт-Тароцци, Сабуро и Булира, агар Эндо.
МПА и МПБ использовали для культивирования различных микроорганизмов неопределенного состава.
Для культивирования анаэробных микроорганизмов использовали среду Китт-Тароцци (МППБ).
Среду Булира и агар Эндо применяли для культивирования кишечной палочки.
Для выращивания грибов использовали среду Сабуро.
Все среды перед бактериологическим исследованием разливали в пробирки по 5 мл. Пробирки закрывали ватно-марлевыми пробками и стерилизовали автоклавированием при температуре 120°С в течение 15–30 минут. МПА после стерилизации скашивали, установив пробирки в наклонном положении до застывания среды.
