Изучение трехмерной структуры с помощью рентгеновской дифракции и реконструкции изображения
Отметим некоторые важные структурные особенности рассматриваемого комплекса.
Все 11 трансмембранных участков представляют собой а-спирали, а составляющие их аминокислоты в большинстве своем неполярны. В каждой из трансмембранных спиралей L-и М-субъединиц имеется последовательность длиной не менее 19 остатков, не содержащая никаких кислых или основных аминокислот.
Трансмембранные спирали в каждой из субъединиц L или М обычно антипараллельны своим соседям, но спирали сие параллельны друг другу. Наклон спиралей к нормали к плоскости мембраны не превышает 25°, за исключением спирали d, которая наклонена к нормали под углом 38°. Длина спиралей варьирует от 24 до 30 остатков.
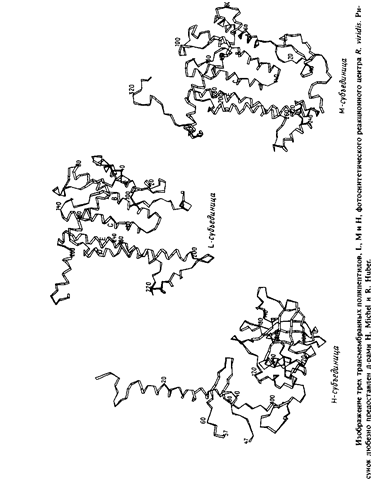
Те участки L - и М-субъединиц, которые соединяют трансмембранные сегменты, образуют уплощенные структуры по обе стороны мембраны, которые могут контактировать с двумя гидрофильными субъединицами.
Заряженные аминокислоты в субъединицах L и М распределены асимметрично, так что полярные концы трансмембранных спиралей и соединяющие их участки заряжены более отрицательно на периплазматической стороне мембраны, чем на цитоплазматической. Это создает определенные энергетические выгоды, поскольку мембранный потенциал отрицателен на цитоплазматической стороне.
Все эти структурные данные ценны также в том отношении, что они помогают понять фотохимию этого важного комплекса.
Хотя редокс-центры, по-видимому, создают два параллельных пути переноса электронов от "специальной пары", эти две ветви не идентичны, и при переносе электронов через мембрану, вероятно, используется только одна из них. Фотосинтетические пигменты жестко фиксируются в определенном месте за счет гидрофобных взаимодействий и водородных связей с белком и вряд ли перемещаются во время реакции.
Перенос электрона от "специальной пары" к бактериофеофитину происходит очень быстро; это согласуется с тем, что участвующие в процессе простетические группы находятся друг от друга на расстоянии вандерваальсового радиуса. Характерное время переноса электрона от бактериофеофитина к Qa составляет 230 пс, и центры этих двух групп разделены расстоянием около 14 А. Однако изопреноидная боковая цепь хинона непосредственно контактирует с бактериофеофитином.
Перенос электрона от цитохрома, сопровождающийся восстановлением специальной пары, происходит медленно, за 270 не, в соответствии с тем, что центр ближайшего гема расположен от центра специальной пары на расстоянии 21 А. Из-за этого, в частности, замедляется перенос электрона.
Перенос QA Qb может осуществляться при участии негемового железа, хотя оно, по-видимому, не является необходимым для этого процесса. Хинон Qb связывается слабо и утрачивается в процессе приготовления образца. Возможно, функциональная роль Н-субъединицы состоит в связывании QB.
Структура трехсубъединичного реакционного центра Rhodobacter sphaeroides, также установленная методом рентгеновской дифракции с разрешением 2,8 А, очень похожа на структуру реакционного центра R. viridis. Модельные исследования позволяют предположить, что негемовое железо и хиноны расположены на уровне полярных концевых групп фосфолипидов внутри бислоя, хотя они полностью окружены белками. Специальная пара бактериохлорофилла находится примерно на 5 А ниже полярных липидных головок. Одиннадцать трансмембранных спиралей упакованы столь же плотно, как аминокислотные остатки внутри водорастворимых белков. Те аминокислотные остатки в трансмембранном участке, которые контактируют с белком, обычно гидрофобны; такая же картина характерна и для соответствующих аминокислот водорастворимых белков. Полярные связи между трансмембранными спиралями весьма немногочисленны. Трехсубъединичная структура стабилизируется за счет:
1) взаимодействия между экспонированными наружу участками субъединиц;
2) благоприятных дипольдипольных взаимодействий между антипараллельными плотноупакованными а-спиралями;
3) вандерваальсовых взаимодействий между плотноупакованными спиралями;
4) связывания одного атома железа с четырьмя гистидиновыми остатками d - и е-спиралей L - и М-субъединиц. Отсутствием полярных взаимодействий между трансмембранными спиралями этот комплекс отличается от большинства моделей бактериородопсина, обсуждаемых в следующем разделе.
В заключение отметим, что реакционные центры бактерий сходны с реакционными центрами фотосистемы II высших организмов, которые ответственны за окисление воды и выделение кислорода. Он содержит единственную ковалентно связанную простетическую группу ретиналь, которая с помощью шиффова основания присоединена к лизину-216. Этот белок выполняет функцию фотохимического протонного насоса, создающего разность электрохимического потенциала протонов, которая затем используется клеткой для транспорта растворимых веществ и синтеза АТР. При поглощении ретиналем одного протона индуцируется ряд превращений, в том числе т/? анс-г/нс-изомеризация по связи С13-С14 ретиналя и депротонирование азота шиффова основания; это приводит к электрогенному переносу одного или двух протонов из клетки наружу.
Поскольку in situ этот белок образует высокоупорядоченную двумерную кристаллическую решетку, для установления его трехмерной структуры можно использовать методы реконструкции изображения. Белок имеет относительно малые размеры и выполняет весьма важную функцию протонного насоса, а за всеми превращениями ретиналя можно следить оптическими методами. Все это стимулировало детальные исследования механизма функционирования бактериородопсина. Фотохимические свойства шиффова основания ретиналя изучены довольно хорошо, однако как они влияют на белок и что вызывает перемещение протонов - неизвестно. Структурные данные тоже не пролили свет на механизм функционирования белка, хотя и были предложены модели протонной "эстафеты" или цепочки трансмембранных водородных связей. С другой стороны, функционально-механистические исследования тоже не дали никаких указаний, которые помогли бы в интерпретации структурных данных.
Структурный каркас бактериородопсина был построен методом реконструкции изображения с использованием электронно-микроскопических данных; это случай наиболее успешного применения данного подхода. Карты электронной плотности позволяют получить разрешение лучше, чем 3,7 А, в плоскости мембраны и около 14 А в плоскости, перпендикулярной бислою. На рис.3.7 представлены одна из карт электронной плотности и соответствующая трехмерная модель. Белок состоит из тримеров, при этом каждый полипептид предстает в виде образования из семи цилиндров, пронизывающих мембрану и примерно перпендикулярных ее плоскости. Обычно считают, что эти цилиндры представляют собой а-спиральные участки белковой молекулы. Их длина по оценкам равна 45 А, что согласуется с рентгеноструктурными данными о том, что толщина пурпурной мембраны составляет примерно 49 А. Если полипептид действительно находится в а-спиральной конфигурации, то эта величина должна соответствовать 30 остаткам, поскольку расстояние между остатками вдоль оси а-спирали равно 1,5 А. Следовательно, в семи предполагаемых а-спиралях содержится более 80% всех аминокислотных остатков. И действительно, как показывают данные КД, большая часть белковой молекулы находится в а-спиральной конфигурации, хотя имеются также участки, образующие 3-слой.
