Страница
5
Дополнение. Вращение белка полосы 3 и цитохрома Р450: выявление межмолекулярных взаимодействий
Из двух указанных белков — белка полосы 3 и цитохрома Р450 — наибольший интерес представляет первый, поскольку по имеющимся биохимическим данным можно предположить, что этот анионный переносчик связан со спектрино-актиновой сетью цитоскелета. Обнаружение того факта, что значительная часть белковых молекул способна к быстрому вращению, послужило основанием для создания моделей, согласно которым белок полосы 3 иммобилизован не полностью или образует со спектрином временную связь. Однако ситуация осложнялась тем, что при лизисе клеток, необходимом для получения теней эритроцитов, комплекс с цитоскелетом может разрушаться. В интактной клетке белок полосы 3 совершает только медленные вращательные движения с характерным временем 0,1 — 1 мс. Это больше согласуется с отсутствием поступательного движения белка полосы 3, хотя физическая причина такого ограничения подвижности не установлена.
Цитохром Р450 акцептирует электроны от цитохром Р450-редук-тазы в электронтранспортной цепи микросом. Многих ученых интересовал вопрос: образуют ли эти молекулы долгоживущий комплекс в мембране или их взаимодействие сводится к простым столкновениям в результате диффузии? При низком соотношении липид/белок цитохром Р450 агрегирует и вращение его замедляется. Однако в присутствии стехиометрических количеств редуктазы цитохром Р450 в сходных условиях остается мобильным. Это свидетельствует о взаимодействии двух указанных белков и образовании комплекса между ними со стехиометрией 1:1, которое препятствует агрегации Р450.
4. Латеральная диффузия липидов и белков в мембранах
Способность мембранных компонентов к латеральной диффузии — это одно из очевидных условий, принятых в жидкостно-мозаичной модели. Для измерения коэффициента латеральной диффузии применялось несколько методов. Рассмотрим три из них.
1.Осуществляют слияние клеток, несущих на своей поверхности различные маркеры, с образованием гетерокарионов. После слияния оценивают скорость перераспределения поверхностных маркеров с помощью флуоресцентной микроскопии и с использованием меченных различными флуоресцентными метками антител против специфических поверхностных антигенов.
2.Осуществляют перераспределение мембранных белков с помощью электрофореза in situ. При внесении клеток в электрическое поле белки концентрируются в одной части мембраны, и коэффициент латеральной диффузии определяют по данным о скорости их перераспределения после отключения электрического поля. За перераспределением белков можно наблюдать с помощью электронной микроскопии или флуоресцентных методов.
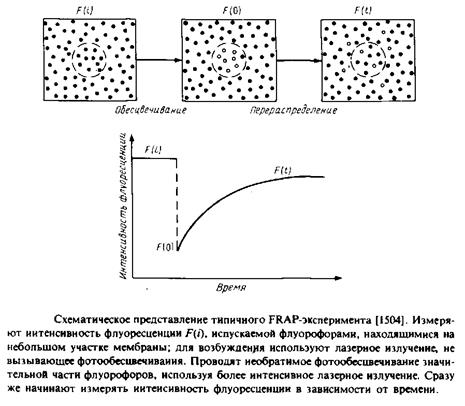
3.Чаще всего используется метод, основанный на восстановлении способности белков к флуоресценции после фотообесцвечивания. Суть метода представлена на рис. 5.6. С помощью мощного лазерного луча обесцвечивают пятно диаметром - 1 мкм на равномерно меченной с помощью флуоресцентной метки мембране. Далее исследуют кинетику разгорания флуоресценции этого участка и по скорости восстановления флуоресценции прямо оценивают скорость латеральной диффузии флуоресцентных зондов на обесцвеченный участок из областей мембраны, прилегающих к нему. С помощью этого метода можно исследовать амфифильные флуоресцентные зонды, меченые фосфолипиды и белки, несущие флуоресцентные метки. Структурные формулы некоторых наиболее часто используемых зондов приведены в табл. 5.1. Можно ожидать, что применение видеотехники для изучения перераспределения флуоресцентных молекул в мембране расширит рамки применения этого метода. Использование двух первых методов сопровождается значительными нарушениями клеток или мембран. Метод FRAP является более щадящим. Опасения, связанные с возможностью повреждений клеток лазерным лучом, были сняты. Метод можно также применять для исследования модельных мембранных бислоев и монослоев, а также интактных клеток или фрагментов биомембран. Фокусируя лазерный луч диаметром ~ 1 мкм в разных точках, можно наблюдать за датеральной диффузией мембранных компонентов в различных участках мембраны.
Коэффициенты поступательной диффузии, которые можно определить с помощью этого метода, варьируют от Ю-7 до 10 ~12 см2/с. Коэффициент диффузии 10 "12 см2/с в рамках этого подхода соответствует отсутствию движения. Значение D = 10 "8 см2/с, характерное для липидов в биомембранах, отвечает диффузии на расстояние около 2 мкм за 1 с.
4.1 Модели, описывающие латеральную диффузию
Для описания поступательной диффузии мембранных белков часто применяется гидродинамическая модель Саффмана и Дельбрюка. В этой модели рассматривается диффузия белка в тонком вязком слое; при этом считается, что растворитель является сплошной средой, т. е. молекулы растворителя малы по сравнению с диффундирующими молекулами. В рамках этой модели выполняется следующее соотношение:
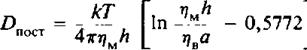
где т)м и 1), — вязкости мембранной и водной фаз соответственно, а — радиус белковой молекулы, имеющей форму цилиндра, h — толщина мембраны. Из модели следует, что скорость поступательной диффузии слабо зависит от размера молекулы, что подтверждается полученными к настоящему времени экспериментальными данными.
 Эта гидродинамическая модель не позволяет описывать диффузию липидных зондов, поскольку к ним неприменимо допущение о том, что белок диффундирует в сплошной среде. Для объяснения поведения липидов применялись различные модели, основанные на концепции свободного объема. В рамках этих моделей диффузия рассматривается как процесс движения молекул в полостях, образующихся вследствие спонтанных флуктуации, при этом определяющей характеристикой мембран является отношение площади, приходящейся на одну молекулу липида, к минимальной Удельной площади, соответствующей максимально плотной упаковке липидов, т. е. плотность упаковки липидов. Как мы уже отмечали, скорость вращения флуоресцентных зондов зависит от плотности упаковки липидов в мембране. Применимость этой модели к описанию вращательной или поступательной диффузии липидов строго не доказана, поскольку изначально она была построена для неассоциированных жидкостей, к которым можно отнести далеко не все мембранные липидные структуры. Тем не менее обратная зависимость между скоростью поступательной диффузии липидов и плотностью упаковки липидов в мембранном бислое обычно существует.
Эта гидродинамическая модель не позволяет описывать диффузию липидных зондов, поскольку к ним неприменимо допущение о том, что белок диффундирует в сплошной среде. Для объяснения поведения липидов применялись различные модели, основанные на концепции свободного объема. В рамках этих моделей диффузия рассматривается как процесс движения молекул в полостях, образующихся вследствие спонтанных флуктуации, при этом определяющей характеристикой мембран является отношение площади, приходящейся на одну молекулу липида, к минимальной Удельной площади, соответствующей максимально плотной упаковке липидов, т. е. плотность упаковки липидов. Как мы уже отмечали, скорость вращения флуоресцентных зондов зависит от плотности упаковки липидов в мембране. Применимость этой модели к описанию вращательной или поступательной диффузии липидов строго не доказана, поскольку изначально она была построена для неассоциированных жидкостей, к которым можно отнести далеко не все мембранные липидные структуры. Тем не менее обратная зависимость между скоростью поступательной диффузии липидов и плотностью упаковки липидов в мембранном бислое обычно существует.
Наконец, несколько подходов использовалось для теоретического объяснения влияния мембранных белков на латеральную диффузию белков и липидов в мембране. Дело в том, что белки оказываются на пути диффундирующих молекул и вынуждают их перемещаться только в пространстве, не занятом белками. Обычно из-за этого коэффициенты поступательной диффузии в биомембранах оказываются примерно в 10 раз меньше, чем в чисто липидных бислоях.
4.2 Примеры латеральной диффузии компонентов мембран
