Страница
3
Все три спектроскопических метода используются для нахождения параметра упорядоченности S:
![]()
cos20 — это усредненная по времени ориентация молекулы относительно нормали к плоскости мембраны. Время, за которое происходит усреднение, зависит от метода: 10~5 с для 2Н-ЯМР, 10~8 с для ЭПР и деполяризации флуоресценции. В случае 2Н-ЯМР этот параметр чувствителен к медленным движениям, совершающимся за времена порядка 10"5 с. Метод ЭПР или деполяризации флуоресценции регистрирует процессы, совершающиеся за время около 10"8 с, а информация о более медленных движениях утрачивается.
Данные о динамических свойствах мембран можно получить с помощью всех трех методов и более прямым способом. Так, из данных ЯМР можно найти времена релаксации, которые в свою очередь зависят от характера молекулярных движений. Из спектра ЭПР можно при определенных условиях найти время вращательной корреляции зонда. Измеряя зависимость степени деполяризации флуоресценции от времени, можно получить данные о динамическом состоянии зонда, а не только оценить степень ограниченности его движения.
2.2 Спиновые метки, использующиеся при изучении текучести мембран
ЭПР — это очень ценный метод изучения мембран. Обычно в качестве меток используются стабильные парамагнитные соединения, содержащие нитроксидный радикал. Неспаренный электрон при наложении сильного магнитного поля переходит с одного энергетического уровня на другой под действием микроволнового излучения. Метод очень чувствителен: обычно спектр регистрируется при концентрации спиновых меток около 10"*М в 50 мкл образца. Спектр ЭПР, как правило, представляют в виде первой производной от спектра поглощения.
В спектре нитроксидного радикала имеются три пика, отвечающие спин-спиновым взаимодействиям неспаренного электрона и ядра атома азота. И положение спектра, и расщепление, обусловленное спином ядра, зависят от ориентации молекулы относительно внешнего поля. Как мы уже говорили в предыдущем разделе, это означает, что характер спектра зависит от характера вращения молекулы. На рис. 5.3 приведены спектры для самых разных случаев — от свободного вращения до полной неподвижности. Для того чтобы найти тк в предположении, что вращательное движение молекулы изотропно, можно использовать простое уравнение, в которое входит высота пиков. Этот подход наиболее применим для такой метки, как TEMPO.
Спиновые метки — производные жирных кислот или фосфолипидов, — конечно, не вращаются изотропно, и в этом случае для нахождения параметра упорядоченности S из величины расщепления между линиями спектра используется вторая простая формула. Предположив, что такие метки имеют форму жесткого стержня, можно из величины параметра S оценить максимальное отклонение зонда от нормали к поверхности мембраны.
Многие предположения, которые делаются при нахождении из спектров ЭПР времен вращательной корреляции или параметра S, снижают ценность этого метода для определения количественных характеристик молекул. Эти параметры тем не менее позволяют получить качественное представление о поведении мембраны. Результаты измерения степени упорядоченности спиновых меток, фиксированных в мембране на разной глубине, свидетельствуют об увеличении неупорядоченности в направлении от поверхности мембраны к ее центральной области. Качественно такая же картина получена с помощью 2Н-ЯМР. Во многих исследованиях проводилось сравнение текучести мембран, которую определяли по данным о величинах тк и S для спиновых меток, при различных возмущающих воздействиях.
2.3 Флуоресцентные зонды, используемые для измерения текучести мембран
Для измерения вращательной диффузии молекул давно используется метод деполяризации флуоресценции. Вращение некоторых зондов в мембранах часто сравнивают с их вращением в маслах с известной вязкостью, при этом пользуются понятием «микровязкость», которую измеряют в пуазах. Термин «микровязкость» означает, что зонд «чувствует» величину вязкости только в своем непосредственном окружении, т. е. этот параметр не является макроскопическим. С точки зрения молекулярного движения подобные измерения не имеют строгого количественного смысла, но, как и в случае со спиновыми метками, полученные результаты позволяют создать ценную качественную картину.
В табл. 1 приведены структурные формулы некоторых зондов, используемых при измерении текучести мембран. Чаще всего применяют ДФГ, поскольку он с легкостью накапливается в мембранах, обладает интенсивной флуоресценцией, по-видимому, не связывается с белками и чувствителен к физическому состоянию мембран. Однако временные измерения свидетельствуют о некой гетерогенности неизвестной природы; кроме того, имеются разногласия по поводу ориентации зонда в бислое и характера его подвижности.
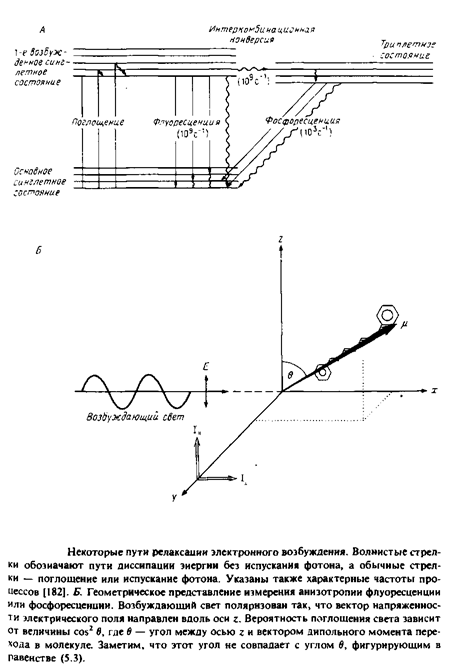
Рис. 4 иллюстрирует принципы, лежащие в основе применения флуоресценции и фосфоресценции для анализа вращения молекул. Молекула, поглотившая фотон, за время 10" 11 с переходит в возбужденное синглетное состояние Si. Термин «синглетное» указывает на то, что спин электрона при поглощении фотона не изменяется. Обычно возвращение в основное, невозбужденное состояние происходит за время - 10"8 с. Причинами такого перехода являются столкновение с соседними молекулами, диссипация энергии в виде тепла или испускание фотона. Характерное время перехода популяции молекул из синглетного возбужденного состояния в основное равно тт. Некоторые молекулы с большой вероятностью переходят из синглетного возбужденного состояния в триплетное, и этот переход сопровождается изменением спина электрона. Испускание фотона при переходе молекулы из этого состояния в основное называется фосфоресценцией. Время жизни молекулы в триплетном состоянии относительно велико, что связано с изменением спинового состояния электрона при испускании фотона.
Рассмотрим принцип метода деполяризации. Свет, поляризованный вдоль оси z, будет предпочтительно возбуждать молекулы, у которых дипольный момент перехода имеет такую же ориентацию. Вероятность возбуждения пропорциональна cos2 в, где в — угол между дипольиым моментом перехода и вектором напряженности электрического поля. Такая же зависимость от cos2 в имеет место и для процесса испускания фотона, поэтому молекула, у которой дипольный момент перехода ориентирован вдоль оси z, будет испускать свет с такой же поляризацией.
Испускаемый свет анализируют с помощью поляризаторов, определяя интенсивность компоненты, параллельной и перпендикулярной направлению поляризации возбуждающего света.
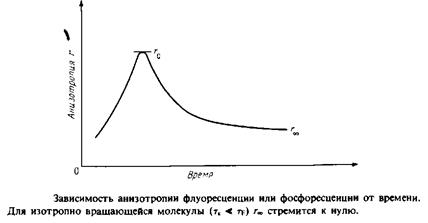
Анизотропия г связана с /, и IL следующим образом:
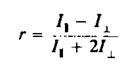
Если между моментами поглощения и испускания света молекула не вращается, то /, будет больше, чем 1±, и г будет иметь максимальное значение 0.4. Если же молекулы, находясь в возбужденном состоянии, совершают интенсивные изотропные вращательные движения, то г будет равно нулю, поскольку в среднем молекулы к моменту испускания света будут ориентированы беспорядочно. При тк = tf величина г будет зависеть от характера движения. При этом т ~ 1 и ту ' отражают скорости вращения и испускания света.
