Страница
2
1.Липидный бислой не является простой вязкой трехмерной гомогенной жидкостью, а представляет собой жидкую среду с низкой вязкостью, у которой состав и динамические свойства в центральной области сильно отличаются от состава и свойств периферических полярных участков.
2.Вращение зондов изотропно, как это имеет место в случае сферических частиц, не обладающих выделенной осью вращения. Часто зонды внутри мембраны имеют предпочтительную ориентацию и их движения ограничены определенными рамками. Интерпретация экспериментальных данных зависит от модели, используемой для описания молекулярного движения.
3.Локализация зондов в мембране может различаться. Например, зонд может быть связан с белковой молекулой или белковыми агрегатами, располагаться внутри липидного домена, который может находиться в различных физических состояниях.
Для оценки текучести определяют спектроскопические параметры низкомолекулярных зондов. К таким параметрам относятся: 1) время вращательной корреляции спиновых меток или флуоресцентных зондов; 2) параметр упорядоченности; 3) стационарная анизотропия флуоресцентных зондов; 4) коэффициент распределения зондов между мембранной и водной фазами. Ясно, что текучесть мембраны, оцененная только по одному параметру, не может служить достаточно полной характеристикой физического состояния мембраны. И все же измерение отдельных параметров весьма полезно, особенно для характеристики изменений физического состояния мембраны, обусловленных, например, изменениями температуры, давления, содержания холестерола, фосфолипидного или ионного состава. Обычно текучесть, измеряемая с помощью спиновых меток и флуоресцентных зондов, однозначно связана с упаковкой липидов в мембране. Воздействия, приводящие к уменьшению площади, приходящейся на одну липидную молекулу, такие, как увеличение гидростатического давления, понижение температуры или добавление холестерола к фосфолипидам в жидкокристаллическом состоянии, вызывают уменьшение текучести. Это согласуется с теорией свободного объема, согласно которой текучесть и плотность связаны между собой обратной зависимостью. Чем более плотная упаковка характерна для мембраны, тем более ограниченным будет движение зонда. Такой подход приемлем при рассмотрении текучести большинства неассоциированных жидкостей.
2. Физиологическое значение текучести мембран
Обычно биомембраны находятся в жидкокристаллическом состоянии, и, по-видимому, поддержание такого состояния очень важно для их функционирования. При переходе мембраны из жидкокристаллической фазы в фазу геля текучесть уменьшается примерно на два порядка. Структурные и динамические свойства бислоя, находящегося в фазе геля, совершенно несовместимы с организацией и правильным функционированием белковых компонентов в мембране. Впрочем, из этого правила имеются несколько исключений. Это, например, полукристаллические области пурпурных мембран Н. halobium, содержащие бактериородоп-син.
Возможно, наиболее яркое доказательство того, что текучесть, измеряемая с помощью спиновых меток или флуоресцентных зондов, играет важную физиологическую роль, получено в исследованиях по адаптации различных организмов к внешним экстремальным воздействиям. Подобные явления наблюдаются чаще всего при изучении термического стресса, когда микроорганизмы, растения, пойкилотермные или зимующие животные подвергаются воздействию низких температур. Адаптация заключается в изменении липидного состава мембран, а именно — в увеличении содержания ненасыщенных липидов или уменьшении средней длины ацильной цепи. Подобные изменения ведут к уменьшению плотности упаковки липидов в мембране и, таким образом, поддерживают текучесть мембраны. Текучесть мембран может быть критичной для одной или более мембранных функций, но каков механизм этого феномена на молекулярном уровне — неизвестно.
2.1 Характер и скорость движений, измеряемых с помощью 2Н-ЯМР, ЭПР и флуоресцентных зондов
Необходимо иметь представление о том, что именно измеряется с помощью мембранных зондов; особенно важно знать, каково отношение между временным интервалом, в котором наблюдается изучаемый тип движения, и временной шкалой, характерной для данного метода. Рассмотрим общий случай, который одинаково применим к ЭПР, измерению флуоресценции или 2Н-ЯМР. Все три спектроскопических метода чувствительны к ориентации молекул относительно лабораторной системы координат. Спектр 2Н-ЯМР чувствителен к ориентации связи С—D относительно приложенного поля. Это связано с тем, что градиент локального поля, векторно суммируясь с внешним полем, дает результирующую, которая и улавливается дейтерием. Аналогичная ситуация характерна и для ЭПР. Спектр ЭПР зависит от ориентации нитроксидной связи N— О, которую содержат большинство обычно используемых зондов, относительно приложенного магнитного поля. В случае флуоресцентной спектроскопии измеряемая поляризация испускаемого света зависит от ориентации дипольного момента перехода молекулы относительно направления, определяемого используемым поляризатором.
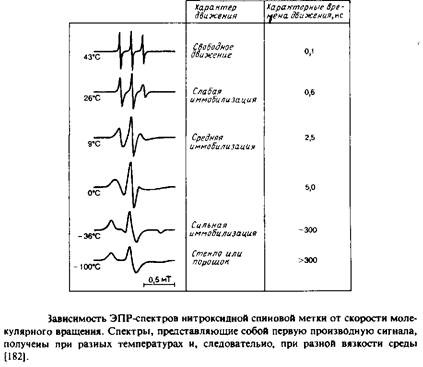
Если молекулы образца ориентированы случайным образом и полностью неподвижны, то каждая субпопуляция, характеризующаяся определенной ориентацией, будет иметь свой уникальный спектр ЭПР или ЯМР, а спектр всего образца будет равен простой сумме этих спектров с учетом их вкладов, определяемых концентрацией соответствующих молекул. Суммарный спектр называется «порошковым» или «твердостекольным» и обычно весьма широк. Такой спектр сильно отличается от спектра образца, в котором молекулы также ориентированы случайным образом, но характерное время их движений гораздо меньше времени измерения. В рассматриваемых нами примерах соответствующие частоты составляют 105 с-1 для 2Н-ЯМР и 108 с"1 для ЭПР. Каждая молекула, совершающая быстрое изотропное движение, воспринимает некое среднее магнитное поле, но при этом для всех молекул это среднее поле одинаково, поэтому пики в результирующем спектре очень острые. Примеры ЭПР-спектров приведены на рис. 5.3. Поскольку характерные времена измерения для методов ЭПР и ЯМР различаются, молекула со временем корреляции 106 с будет казаться неподвижной в первом случае и очень быстро движущейся во втором.
Метод измерения деполяризации флуоресценции состоит в том, что образец облучают поляризованным светом и спустя несколько наносекунд регистрируют испускаемый свет. Если молекулы остаются неподвижными в течение времени между процессами поглощения света и его испускания, то поляризация испускаемого света будет определяться в основном поляризацией света возбуждающего. Если же молекула совершает быстрое изотропное вращение, то вектор напряженности электрического поля испускаемого света не будет иметь предпочтительной ориентации, поскольку поляризация будет равна нулю. Значения поляризации, находящиеся между этими двумя крайними величинами, соответствуют или медленным движениям, при которых популяция молекул не успевает достичь полностью разупорядоченного состояния за время 10-8 с, или быстрым движениям, ограниченным в пространстве и, следовательно, не допускающим полную разупорядоченность.
