Страница
11
2.6 Построение диаграмм рН – потенциал систем сплав МН19 – H2O и сплав МНЖМц30–1–1 – Н2О при 25оС
Линии на диаграммах рН – потенциал рассчитываются по равновесным процессам. В общем виде для процесса
![]() (2.42)
(2.42)
![]() (2.43).
(2.43).
Поскольку ![]() , то
, то
![]() (2.44).
(2.44).
Здесь φi – равновесный электродный потенциал реакции, φio – стандартный электродный потенциал.
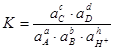 (2.45).
(2.45).
И, после подстановки (2.45) в (2.44), перехода от натуральных логарифмов к десятичным и учёта того, что ![]() :
:
![]() (2.46).
(2.46).
Диаграммы рН – потенциал строят, зафиксировав активности компонентов, находящихся в растворе, так чтобы последний член равенства (2.46) был постоянным. Затем строят прямую линию, пересекающую ось потегциалов в точке ![]() с тангенсом угла наклона, равным
с тангенсом угла наклона, равным ![]() . При 25оС
. При 25оС ![]() .
.
Наклонные линии на диаграмме ![]() будут соответствовать равновесиям, в которых принимают участие и электроны и ионы Н+, горизонтальные линии
будут соответствовать равновесиям, в которых принимают участие и электроны и ионы Н+, горизонтальные линии ![]() – равновесиям, в которых не принимают участие ионы Н+, вертикальные линии
– равновесиям, в которых не принимают участие ионы Н+, вертикальные линии ![]() – чисто химическим равновесиям, без участия электронов.
– чисто химическим равновесиям, без участия электронов.
Линии чисто химических равновесий нельзя построить с использованием уравнений (2.43) – (2.46). Вместо них используются уравнения
![]() (2.47),
(2.47),
![]() (2.48),
(2.48),
![]() (2.49).
(2.49).
В данной работе построены диаграммы рН – потенциал для систем сплав МН19 – вода и сплав МНЖМц30–1–1 – вода при активностях ионов в растворе равных ![]() ,
, ![]() ,
, ![]() .
.
При построении линий, соответствующим равновесиям с участием металлов, их активности принимаются равными активностям компонентов сплавов МН19 и МНЖМц30–1–1 (см. табл. 2.4.). Активности всех оксидов принимаются равными единице.
На всех построенных диаграммах все оксиды представлены в виде негидратированных форм.
При построении диаграмм были использованы литературные данные [14 – 16].
Диаграмма рН – потенциал системы сплав МН19 – Н2О при условии ![]() приведена на рис. 2.2. Основные химические и электрохимические равновесия указаны в табл. 2.8.
приведена на рис. 2.2. Основные химические и электрохимические равновесия указаны в табл. 2.8.
Диаграмма рН – потенциал системы сплав МН19 – Н2О при условии ![]() приведена на рис. 2.3. Основные химические и электрохимические равновесия указаны в табл. 2.9.
приведена на рис. 2.3. Основные химические и электрохимические равновесия указаны в табл. 2.9.
Диаграмма рН – потенциал системы сплав МН19 – Н2О при условии ![]() приведена на рис. 2.3. Основные химические и электрохимические равновесия указаны в табл. 2.10.
приведена на рис. 2.3. Основные химические и электрохимические равновесия указаны в табл. 2.10.
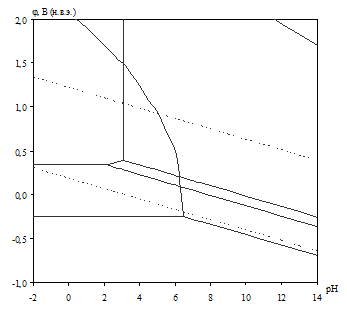
Рис. 2.2. Диаграмма рН – потенциал системы сплав МН19 – Н2О при 25оС, ![]() атм. (воздух) и
атм. (воздух) и ![]() .
.
Табл. 2.8. Основные химические и электрохимические равновесия в системе сплав МН19 – Н2О при 25оС, ![]() атм. (воздух) и
атм. (воздух) и ![]()
|
№ линии |
Электродная реакция |
Равновесный потенциал (В) или рН раствора |
|
1 |
|
-0,248 |
|
2 |
|
0,135–0,0591pH |
|
3 |
|
|
|
4 |
|
0,338 |
|
5 |
|
0,465–0,0591pH |
|
6 |
|
0,575–0,0591pH |
|
7 |
|
0,211+0,0591pH |
|
8 |
|
pH 3,08 |
|
9 |
|
3,360–0,1182pH |
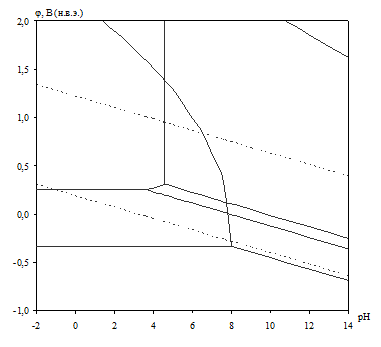
Рис. 2.3. Диаграмма рН – потенциал системы сплав МН19 – Н2О при 25оС, ![]() атм. (воздух) и
атм. (воздух) и ![]() .
.
Табл. 2.9. Основные химические и электрохимические равновесия в системе сплав МН19 – Н2О при 25оС, ![]() атм. (воздух) и
атм. (воздух) и ![]()
|
№ линии |
Электродная реакция |
Равновесный потенциал (В) или рН раствора |
|
1 |
|
-0,337 |
|
2 |
|
0,135–0,0591pH |
|
3 |
|
|
|
4 |
|
0,250 |
|
5 |
|
0,465–0,0591pH |
|
6 |
|
0,575–0,0591pH |
|
7 |
|
0,034+0,0591pH |
|
8 |
|
pH 4,58 |
|
9 |
|
3,272–0,1182pH |
