Исследование апоптотической активности лимфоцитов периферической крови
2.2.3. Исследование фрагментации ДНК лимфоцитов
15 мкл суспензии ДНК каждой пробы использовали для электрофоретической идентификации апоптоза клеток, 35 мкл для оценки содержания фрагментированной ДНК в лимфоцитах.
2.2.4. Электрофорез ДНК лимфоцитов
Электрофорез проводили в 1,5 % агарозном геле с добавлением 1 мкг/мл бромистого этидия при напряжении 20 В/см в течение 30 минут. Полученные гели просматривали и фотографировали в УФ-свете.
На электрофореграммах апоптотическая фрагментация ДНК выявлялась в виде “лесенки” из фрагментов ДНК различной длины. Некроз клеток обуславливал “размазанный” характер зоны миграции ДНК. Полоса свечения интактной ДНК находилась в районе старта.
2.2.5. Определение содержания фрагментированной ДНК в лимфоцитах
Содержание ДНК в пробах определяли дифениламиновым методом [Шаткин А., 1972]. К 1 мл гидролизованной ДНК добавляли 2 мл реактива Дише (1 г дифениламина, 100 ледяной уксусной кислоты, 2,75 мл концентрированной серной кислоты) и инкубировали в течение 16-20 часов при 30С. После инкубировали в кипящей водяной бане 10 минут для развития окраски. После этого пробы охлаждали и исследовали с помощью спектрофотометра СЭФ-46 при длине волны 600 нм. В качестве раствора сравнения использовали аналогичный раствор без ДНК.
Содержание ДНК (мкг) в лимфоцитах рассчитывали по калибровочной кривой с использованием стандартного раствора ДНК клеток тимуса теленка (1 мг/мл), 0,5 мл которого предварительно смешивали с равным объемом 0,1 Н раствора и гидролизовали в течение 10 минут в кипящей водяной бане и разбавляли 0,5 Н раствором HCIO4 до необходимой концентрации.
2.3. Исследование морфологии апоптоза лимфоцитов
После инкубации пробы центрифугировали 10 минут при 1000 об/мин, надосадочную жидкость удаляли, а из осадка готовили мазки, которые окрашивали азур-эозином в течение 40-50 минут. Для оценки морфологии апоптотических изменений лимфоцитов использовали цитопатологические критерии, предложенные S. G. Martin e.a. [Маянский А. Н., 1997]
2.4. Статистическая обработка результатов
![]()
![]()
![]() Полученные данные обрабатывали на Statistica for Windows (версия 6.0) и пакета программ Microsoft Excel (1997). Для всех имеющихся выборок данных проверена гипотеза нормальности распределения (по критерию Колмогорова-Смирнова). Для каждой выборки вычисляли средневыборочные характеристики.
Полученные данные обрабатывали на Statistica for Windows (версия 6.0) и пакета программ Microsoft Excel (1997). Для всех имеющихся выборок данных проверена гипотеза нормальности распределения (по критерию Колмогорова-Смирнова). Для каждой выборки вычисляли средневыборочные характеристики.
`Х - среднее арифметическое;
`![]() - среднее квадратичное отклонение;
- среднее квадратичное отклонение;
m – ошибка среднего;
по формуле:
`Х = åа / n (1);
`![]() =
= 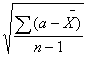 (2);
(2);
m = ± ![]() (3);
(3);
где а – величины, полученные при исследовании;
n – число исследований.
При соответствии нормальному закону распределения признака в исследуемых выборках, проверка гипотезы о равенстве средних выборочных величин производилась с использованием t-критерия Стьюдента. Для оценки достоверности различий выборок, не подчиняющихся критерию нормального распределения, использовали непараметрический критерий Манна-Уитни. Различия считали достоверными, при уровне значимости p<0,05 [Лакин А.В.,1989].
Глава 3. Результаты исследований
3.1 Количественные показатели периферической крови у детей, больных инфекционным мононуклеозом и острыми инфекционными заболеваниями с мононуклеозоподобным синдромом
3.1.1 Количественные показатели периферической крови у детей, больных инфекционным мононуклеозом в различные периоды течения и через 16-18 месяцев после болезни
При исследовании количественных показателей периферической крови у детей, больных ИМ, в развернутую стадию клинико-гематологических проявлений наблюдалось достоверное увеличение общего количества лейкоцитов (10,15±0,67 Г/л, p1<0,001), обусловленное достоверным увеличением абсолютного содержания лимфоцитов (5,13±0,42 Г/л, p1<0,001) и моноцитов (0,73±0,13 Г/л, p1<0,001) (табл. 2), при этом относительное количество лимфоцитов и моноцитов существенно не превышало значений нормы.
Как следует из табл. 2, у больных ИМ, в острый период заболевания, в периферической крови отмечалось значительное повышение относительного и абсолютного содержания атипичных мононуклеаров (АМ) (в среднем в 14,3, p1<0,001 и в 8, p1<0,001 раз соответственно) (табл. 2).
Кроме того, отмечалось достоверное повышение относительного (2,43±0,5 %, p1<0,001) и абсолютного (0,29±0,07 Г/л, p1<0,001) количества палочкоядерных нейтрофилов (табл. 2).
На фоне достоверного снижения в периферической крови, у данной группы больных, относительного содержания эозинофильных (1,03±0,28 %, p1<0,05) и сегментоядерных (20,29±2,28 %, р1<0,001) гранулоцитов, их абсолютное число существенно не изменялось по сравнению с контролем (табл. 2).
В период реконвалесценции, у больных ИМ, наблюдалось снижение общего количества лейкоцитов периферической крови (7,38±0,79 Г/л, р2<0,01) по сравнению с 1 группой, превышая аналогичный показатель нормы в 1,2 раза (р1<0,001) (табл.2).
В данный период исследования относительное и абсолютное количество лимфоцитов периферической крови оставалось повышенным (59,98±2,55 %, р1<0,01) и (4,31±0,46 Г/л, р1<0,001) по сравнению с группой здоровых детей, кроме того, отмечалась незначительная тенденция к повышению относительного, но при этом к снижению абсолютного содержания лимфоцитов периферической крови, по сравнению с 1 группой детей (табл.2).
Также, в крови больных ИМ, отмечалось достоверное снижение относительного и абсолютного количества АМ периферической крови, в 4,0 (р2<0,001) и 5,0 (р1<0,001) раза соответственно, по сравнению с аналогичными показателями 1 группы, при этом данные показатели существенно превышали уровень нормальных значений (табл. 2)
Отмечалось восстановление до уровня нормы абсолютного и относительного числа моноцитов, эозинофилов и палочкоядерных нейтрофилов (табл. 2). Кроме того, количество сегментоядерных гранулоцитов периферической крови, в период выздоровления и через 16-18 месяцев после перенесенного заболевания, также оставалось сниженным, что составляло 64% (р1<0,001) и 66% (р1<0,001) от уровня нормы (табл.2).
Через 16-18 месяцев после ИМ, общее количество лейкоцитов оставалось незначительно повышенным по сравнению с нормой, и отмечалась тенденция к снижению данного показателя при сравнении с периодом выздоровления (табл. 2).
В катамнезе, абсолютное и относительное содержание в периферической крови АМ, продолжало достоверно снижаться по сравнению со 2 периодом (0,38±0,05 Г/л, р3<0,05) и (5,52±0,7 %, р3<0,05), соответственно, по прежнему значимо превышая контрольные значения (табл.2).
