Страница
3
В тех случаях, когда транспортный процесс становится узким местом, лимитирующим общую скорость метаболизма, воздействие, активирующее транспорт или повышающее избирательную проницаемость клеточной оболочки, может положительно влиять на скорость роста организма. Этап функционирования ферментов может оказаться рост-лимитирующим звеном метаболизма лишь при отсутствии в клетке необходимого количества фермента. При этом быстро включаются компенсирующие механизмы: наступает индукция фермента или снимается репрессия его синтеза. Для конститутивных ферментов возможна стимуляция на уровне трансляции. Только при недостаточной эффективности всех этих регуляторных механизмов количество фермента может оказаться неадекватным условиям роста.
Во многих случаях несбалансированного роста наиболее вероятными претендентами на роль «узких мест» метаболизма являются процессы синтеза макромолекул, особенно РНК и белка. Этап репликации редко выступает в качестве узкого места метаболизма, хотя скорость элонгации ДНК – величина достаточно постоянная, составляющая у Escherichia coli около 2000 пар нуклеотидов в секунду, и мало зависит от условий выращивания. Это объясняется специальной организацией регуляторных механизмов, настроенных таким образом, что при улучшении условий питания повышается частота инициации новых циклов репликации ДНК. Поэтому, если время генерации меньше, чем период репликации ДНК, то новые циклы репликации инициируются до завершения старых и в быстро растущих клетках ДНК присутствует в виде сильно разветвленной структуры, соответствующей по массе 3–8 эквивалентам генофора. При этом, очевидно, локусов, расположенных вблизи от точки начала репликации, в клетке значительно больше, чем расположенных ближе к точке терминации, что может вызывать повышение синтеза некоторых белков. Однако чаще всего эффект дозы гена не проявляется из-за регуляции на уровне транскрипции и трансляции.
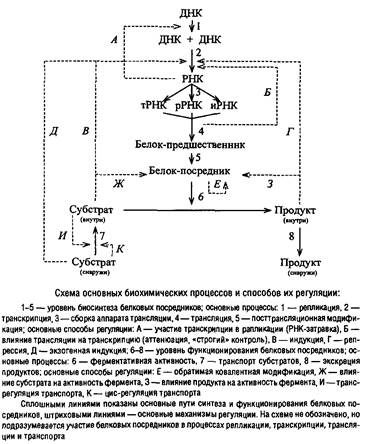
Менее определенной оказывается ситуация с транскрипцией. Длительное время считалось, что скорость элонгации в транскрипции является такой же постоянной величиной, как и в репликации. Но появляется все больше сведений о том, что в транскрипции она может варьировать.
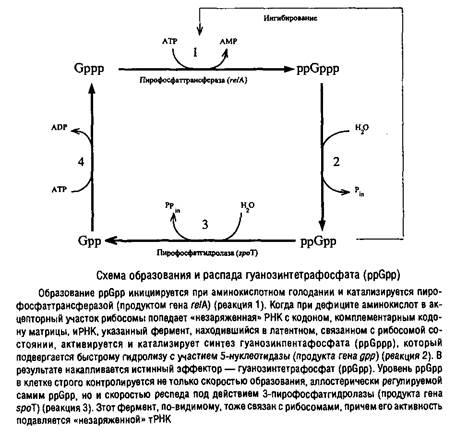
Существует тесное сопряжение между элонгацией РНК в процессе транскрипции и элонгацией полипептидной молекулы в процессе трансляции, и выражается оно не только в пространственном сопряжении процессов, как это имеет место при аттенюации, но и в регуляторном воздействии через молекулы эффекторов. Торможение элонгации трансляции приводит к синтезу специфического эффектора гуанозинтетрафосфата, который существенно влияет на процесс транскрипции.
Дефицит энергии также тормозит гидролиз ppGpp, так как активность пирофосфатгидролазы АТР-зависима. Таким образом, при аминокислотном голодании не только стимулируется синтез PpGpp, но и тормозится его гидролиз.
Кроме этого механизма, по-видимому, существует еще один путь синтеза ppGpp, так как при дефиците источников энергии он накапливается даже в клетках мутанта Escherichia coli. У некоторых бацилл и стрептомицетов установлен фактор, независимый от рибосом, катализирующий синтез ppGpp при снижении уровня АТР в клетке. Накопление ppGpp в клетках приводит к резкому торможению образования стабильных форм РНК и, соответственно, к торможению формирования аппарата трансляции, избыточное количество которого в условиях голодания становится излишним и даже вредным. Это и есть так называемый строгий контроль. Одновременно подавляется транскрипция локусов рибо-сомных белков и факторов элонгации трансляции. Однако ppGpp оказывает и положительное действие на транскрипцию: он стимулирует транскрипцию некоторых аминокислотных регулонов, а также регулонов азотного метаболизма.
Кроме влияния на транскрипцию ppGpp регулирует активность ряда ключевых ферментов метаболизма, участвующих в образовании нуклеотидов, фосфолипидов, пептидогликана, в транспорте азотистых оснований и т.д. Наконец, ppGpp активирует некоторые протеолитические системы клетки, ускоряя внутриклеточный протеолиз.
Все изложенное делает понятной необходимость тонкой регуляции уровня ppGpp в клетке.
Необходимо отметить, что гуанозинполифосфаты аналогичного или иного строения обнаружены в клетках многих про- и эукариот, где они выполняют различные регуляторные функции.
Таким образом, сопряженный процесс транскрипции-трансляции оказывается во многих случаях решающим этапом приспособления клетки к условиям голодания, например при переносе на бедную среду.
При обратной ситуации – переносе клеток на богатую среду (shift-up) именно процессы сопряженной транскрипции-трансляции являются наиболее узким местом метаболизма, лимитирующим общую скорость роста популяции.
После обогащения среды происходит «вспышка» синтеза белка, тРНК переходит в «заряженное» состояние, в результате резко снижается образование ppGpp и запускается быстрый синтез стабильных форм РНК, чему способствует множественная репрессия ранее функционировавших оперонов, В итоге синтез белка и скорость роста увеличиваются, пока позволяет сопряженное функционирование процессов транскрипции-трансляции.
Из всего изложенного следует практический вывод, касающийся селекции и конструирования штаммов-продуцентов, способных к «сверхсинтезу» ценных продуктов. Например, для стимуляции синтеза аминокислот образование ppGpp оказывается полезным, поэтому более перспективными продуцентами могут оказаться штаммы Ret. Напротив, конструирование штаммов, образующих белковые продукты, предполагает необходимость подавления внутриклеточного протеолиза, что требует использования штаммов Ret или других условий, подавляющих образование ppGpp.
