Страница
2
Можно получить и обратную картину, если ингибировать построение клеточной перегородки низкими концентрациями пенициллина G. Аналогично действует повышение температуры в случае некоторых л-мутантов. При этом рост клетки и репликация ДНК могут продолжаться, приводя к возникновению «многонуклеоидных» нитей, которые после удаления ингибитора фрагментируются на соответствующее число нормальных клеток.
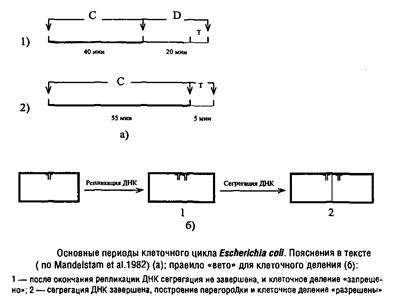
Замечено, что клеточный цикл прокариот, таких как Escherichia coli, при росте на минеральной среде с глюкозой можно подразделить на два основных периода. Они получили обозначения периодов Си D. Иногда в периоде D выделяют еще период Т – время от появления первых признаков клеточной перегородки до завершения клеточного деления.
Период С в норме занимает около 40 мин., фактически представляя собой время полной репликации генома Escherichia coli, которое мало зависит от скорости роста. В последнем случае инициация нового цикла репликации ДНК происходит до завершения клеточного деления, и дочерние клетки получают уже частично реплицированную ДНК, так что к моменту деления репликация успевает завершиться.
Период D занимает около 20 мин. – между моментом завершения репликации и моментом окончательного формирования клеточной перегородки.
Для нормального протекания клеточного цикла необходимо, чтобы в период С происходила не только репликация ДНК, но и синтез белка и РНК, так как ингибиторы транскрипции и трансляции, введенные в течение периода С, тормозят клеточное деление и увеличивают время генерации. Если же ввести эти ингибиторы на период, не превышающий 15 мин., деление клетки завершается вовремя. Очевидно, что минимальная длительность периода D может быть равна периоду Т, т.е. времени, необходимому для сборки перегородки. Эти выводы подтверждаются фактом, что данные ингибиторы, введенные в период D, не тормозят клеточное деление. Следовательно, предшественники, необходимые для построения клеточной перегородки, и другие белки, важные для завершения деления клетки, синтезируются в период С и хранятся в резерве до начала сборки перегородки.
Центральное место в проблеме регуляции клеточного деления занимает вопрос о природе сигнала, необходимого для запуска процесса сборки клеточной перегородки. Длительное время считалось, что этим сигналом является терминация репликации ДНК, однако рассмотренные нами свидетельства, указывающие на отсутствие облигатной связи между этими процессами, делают подобное заключение сомнительным.
Недавно установлено, что подавление сегрегации вновь синтезированных цепей ДНК, достигаемого в период D за счет сборки клеточной оболочки из предшественников, препятствует завершению клеточного цикла. Поэтому можно полагать, что для нормального построения клеточной перегородки от ДНК должен быть освобожден сайт, ответственный за сборку перегородки, локализованный в экваториальной части клетки и занятый ДНК сразу после завершения ее репликации. Отсюда вывод: регуляторное взаимодействие между репликацией ДНК и построением клеточной перегородки состоит в своеобразном правиле «вето» со стороны ДНК. Если нарушен процесс нормальной сегрегации реплицированной ДНК и соответствующее место в экваториальной области клетки занято, то сборка клеточной перегородки не может быть осуществлена и клеточное деление тормозится. Формально в этом случае наблюдается зависимость между репликацией ДНК и делением клетки.
Взаимодействие регуляторных механизмов при управлении скоростью роста микроорганизмов
Один из узловых вопросов, связанных с управлением скоростью роста микроорганизмов – о механизмах перестройки метаболизма микробной клетки при изменении состава питательной среды.
В хемостатной культуре регулирование состава среды позволяет получить клетки определенного химического состава, а иногда и с заранее заданными свойствами. Например, для получения клеток, обогащенных белком, но со сниженным содержанием нуклеиновых кислот целесообразно использовать лимитирование по фосфору.
При обогащении среды, допустим, путем добавления дополнительных питательных веществ, а в хемостатной культуре путем увеличения протока среды, скорость роста увеличивается до нового значения, которое, как правило, не является максимально возможным в силу неполной реализации потенциала клетки. Это происходит из-за наличия так называемых узких мест, т.е. биохимических реакций, ограничивающих скорость всего процесса, а выявляя их, можно получить максимальный выход биомассы и ценных для человека продуктов метаболизма.
Таблица 1. Влияние различных видов лимитирования на состав клеток микроорганизма (типа Escherichia coli)
|
Лимитируемый источник |
Состав клеток | |||
|
Белок |
Нуклеиновые кислоты |
Липиды |
Запасные вещества | |
|
Углерод |
Не влияет |
Не влияет |
Снижает |
Снижает |
|
Азот |
Снижает |
Снижает |
Повышает |
Повышает |
|
Фосфор |
Не влияет или повышает |
Снижает |
Снижает |
Повышает |
|
Цинк |
Не влияет |
Снижает |
Не влияет |
Не влияет |
Рассмотрим значение разных уровней регуляции, представленных на схеме, для управления общей скоростью роста организма.
Обычно скорость транспорта субстратов более или менее точно сбалансирована со скоростью их метаболизма, а иногда превышает ее. В последнем случае в клетке формируется резерв субстратов, способный оказывать разнообразное, в том числе тормозящее, действие на метаболизм клетки, если отсутствует трансрегуляторное ингибирование транспорта этих субстратов из среды их внутриклеточным пулом. При некоторых условиях транспорт оказывается лимитирующим этапом метаболизма, например при дефиците в среде необходимых субстратов и кофакторов, особенно в случае организмов, не способных к синтезу данных веществ или осуществляющих эти процессы с пониженной скоростью. Аналогичная ситуация создается при недостаточной эффективности транспортных систем, даже если в среде избыток субстрата. Этап выделения продуктов может лимитировать рост, если продукт обладает ингибиторным или отрицательным регуляторным действием на метаболизм. В клетке при этом может вырабатываться специальный механизм для активного удаления таких веществ.
