Страница
1
Существует понятие о клеточном цикле – последовательности событий от одного деления клетки до другого. Клеточный цикл прокариотической и эукариотической клеток различается весьма существенно. Учитывая большую сложность организации клеток эукариот, проще начать с рассмотрения механизмов регуляции процессов клеточного деления и роста клеток прокариот, тем более что в биотехнологических процессах все большее распространение получает культивирование эукариотических клеток с использование подходов, применяемых для культивирования одноклеточных прокариот.
Последовательность событий в процессе деления клетки
Процесс клеточного деления у прокариот включает следующие события в определенной очередности:
1) накопление «критической» клеточной массы;
2) репликация ДНК генома;
3) построение новой клеточной оболочки;
4) построение клеточной перегородки;
5) расхождение дочерних клеток.
Некоторые из этих событий протекают одновременно, другие строго последовательно или вообще могут отсутствовать.
Регуляция клеточного деления складывается из регуляции каждого из этих событий и организации их взаимодействия, при котором в клеточном делении устанавливается последовательность процессов и вырабатываются сигналы для инициации следующего по порядку процесса.
Накопление критической клеточной массы и репликация ДНК
Это необходимые подготовительные этапы собственно клеточного деления. Следует отметить, что размер клеток каждого микроорганизма, растущего сбалансированно в стандартных условиях, является достаточно постоянной величиной, чтобы служить одним из таксономических признаков. В.Д. Донаши даже ввел понятие элементарной клетки, т.е. наименьшей, возможной для данного микроорганизма. Таким образом, существуют механизмы, включающие процесс деления клетки при накоплении ее пороговой массы.
Построение новой клеточной оболочки
Необходимо различать пролиферацию цитоплазматической мембраны и клеточной стенки и сегрегацию поверхностных структур.
При изучении пролиферации используют, как правило, синхронные культуры микроорганизмов и изучают включение меченных радиоизотопами соединений путем равновесного или импульсного введения этих соединений.
Таким путем установлено, что включение белков в цитоплазматическую мембрану Escherichia coli и Bacillus subtilis следует сложной кинетике, свидетельствующей о запасании предобразованных белков в цитоплазме, в период подготовки клеточного деления и быстрой их мобилизации – в процессе построения клеточной перегородки. В период деления возрастает активность некоторых литических ферментов, участвующих в образовании «брешей» в предсуществующем каркасе клеточной стенки, необходимых для включения новых ее фрагментов. Таким образом, регуляция активности этих ферментов осуществляется путем временного перевода их в скрытое состояние с последующей мобилизацией в необходимый момент. Точных данных о механизмах такой регуляции нет, но можно полагать, здесь имеет место взаимодействие ферментов с мембранами.
При изучении сегрегации поверхностных слоев также используют введение в эти структуры меченых предшественников с прослеживанием их судьбы через несколько генераций после переноса клеток на среду, не содержащую метки. Наблюдения обычно осуществляют методом электронно-микроскопической радиоавтографии, где в качестве метки используется тритий, который в силу небольшой энергии р-частиц дает на радиоавтографах короткие треки, удобные для определения мест локализации метки.
Другой подход – наблюдение за образованием и распределением маркеров структурных компонентов оболочки в течение нескольких генераций после их индукции. В этом случае удобно использовать специфические маркеры клеточной стенки или цитоплазматической мембраны, или, наконец, такие общие маркеры, как жгутики.
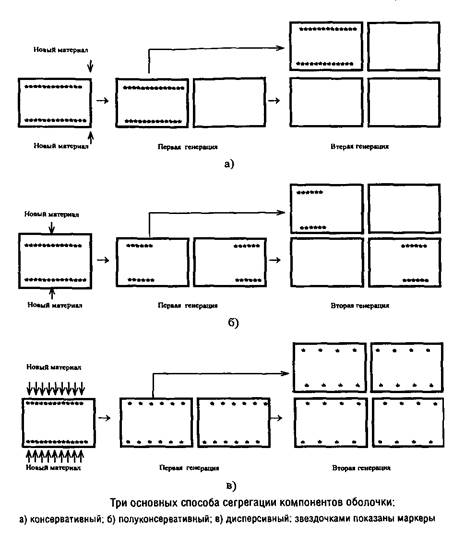
Можно представить себе три основных способа локализации сайтов включения предшественников: консервативный, полуконсервативный и дисперсивный. В первом случае после второй генерации лишь четверть клеток содержит маркеры, во втором случае – половина клеток, а в третьем – все клетки.
Вопрос о механизме сегрегации поверхностных слоев можно считать более или менее однозначно решенным лишь для кокковидных форм бактерий в случае, если они характеризуются мономорфным клеточным циклом и делятся в одной плоскости. Для этих форм разные экспериментальные подходы дают сходную картину, указывающую на полуконсервативный способ сегрегации. Для палочковидных форм бактерий сведения о способе сегрегации противоречивы.
Однозначное установление локализации мест включения мембранных компонентов затрудняется их значительной латеральной подвижностью, составляющей, например, для липополисахарида наружной мембраны Escherichia coti около 1 мкм за 25 с. Кроме того, способ сегрегации может определяться скоростью роста микроорганизма: у медленно растущих клеток Escherichia coii он близок к биполярному, а у быстро растущих становится днсперсивным.
Построение клеточной перегородки
В изучении механизмов регуляции данного этапа клеточного цикла важную роль сыграли специфические мутанты, особенно мутанты Escherichia colt и Bacillus subtilis, образующие миниклетки-мутанты). Миниклетки возникают на полюсах нормальных клеток, имеют небольшие размеры и не содержат хромосомной ДНК. Однако у них нормальный аппарат транскрипции и трансляции, поэтому они могут быть использованы для изучения функционирования захваченных из материнской клетки плазмид, а также введенных извне искусственных генетических элементов, полученных методами генетической инженерии. Именно существование т/л-мутантов позволило сделать вывод, что сайт, ответственный за образование перегородки и локализующийся в процессе деления в экваториальной зоне клетки, сохраняется на полюсах дочерних клеток. В норме эти полярные сайты выключаются и могут функционировать наряду с вновь формирующимися экваториальными сайтами лишь у mm‑мутантов.
В любой из клеток т/л-мутанта одновременно существуют два функционально активных сайта построения перегородки, но в клеточном цикле срабатывает лишь один из них.
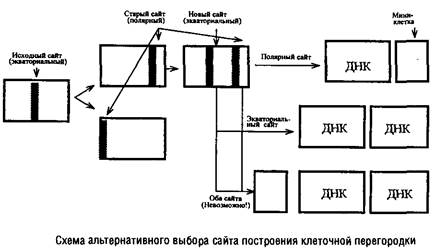
Оказалось невозможным образование одновременно трех клеток: двух нормальных и одной мини. Поэтому сделан вывод о существовании определенного компонента – активатора сборки клеточной перегородки. По-видимому, на протяжении клеточного цикла образуется ограниченное количество этого активатора, достаточное для функционирования лишь одного сайта, и оно полностью расходуется в этом процессе.
Обнаружить существование такого кванта в нормальных клетках невозможно, так как количество квантов активатора и количество функционирующих сайтов у них совпадает, а у т/л-мутантов это количество превышает число квантов активатора.
Характер взаимосвязи процессов клеточного деления
Между процессом накопления критической массы клетки, репликацией ДНК и построением клеточной перегородки не обнаружено облигатно-реципрокной связи, при которой подавление одного из процессов тормозило бы другие и наоборот. Например, в случае Bacillus subtitis возможно построение перегородки и формирование клеток нормального размера после подавления репликации ДНК налидиксовой кислотой. В результате одна из дочерних клеток не содержит ДНК. Кстати, такие клетки, не содержащие ДНК, нечувствительны к пенициллину, вызывающему лизис только активно растущих клеток, поэтому данный антибиотик можно использовать для получения их чистой популяции без ДНК для дальнейших исследований.
