Исследование соотношения в мышцах С- и Х-белков в норме и при патологии
Продолжение таблицы 2.
|
гелсолин |
α-спираль + β-структура |
наследственный системный амилоидоз |
отдельные внутренние органы и ткани |
|
кальцитонин |
развернутый |
медуллярный рак щитовидной железы |
щитовидная железа |
|
медин |
β-структура |
амилоидоз аорты |
аорта |
|
сывороточный амилоид А и его фрагменты |
α-спираль + β-структура |
АА амилоидоз |
желудок, щитовидная железа, почки |
|
цистатин С |
α-спираль + β-структура |
наследственная цистатин С амилоидная ангиопатия (болезнь кровеносных или лимфатических сосудов) |
мозг |
|
инсулин |
α-спираль |
подкожнолокализованный амилоидоз |
кожа, мышцы |
Таблица 3.
Амилоидогенные белки и пептиды, к настоящему времени не связанные с болезнями (см. ссылки в обзоре Uversky & Fink 2004).
|
Амилоидогенный белок |
Тип структуры |
Амилоидогенный белок |
Тип структуры |
|
бетабелин 15D и 16D |
β-структура |
миоглобин |
α-спираль |
|
цитохром с552 |
α-спираль |
мышечная ацилфосфатаза |
α-спираль + β-структура |
|
SH3-домен |
β-структура |
Аполипопротеин С II |
развернутый |
|
β-лактоглобулин |
β-структура |
протимозин α |
развернутый |
|
ацилфосфатаза |
α-спираль + β-структура |
метионин аминопептидаза |
α-спираль |
Процесс олигомеризации и фибриллообразования происходит при взаимодействии молекул белка за счет электростатических, водородных и гидрофобных взаимодействий с образованием димеров – начальных строительных блоков (рис. 4). Например, значительный вклад в фибриллогенез Аβ-пептида вносят гидрофобные взаимодействия. Дальше димеры олигомеризуются в тетрамеры, октамеры и т. д. с образованием протофибрилл шириной 2–3 нм и длиной до 200 нм. Эти образования накапливаются в лаг-фазе, характерной для кинетики фибриллообразования. Окончание лаг-фазы связано с образованием протофибриллами фибрилл диаметром 7–8 нм. События, происходящие в лаг-фазе, представляют большой интерес, так как именно на этой стадии с помощью микроскопа можно наблюдать кинетику фибриллогенеза, а также морфологию постепенно формирующихся агрегатов (т. е. динамику процесса) (Zerovnik, 2002). Причем, один и тот же белок может образовывать амилоидные агрегаты разной морфологии, т. е. обладать полиморфизмом, как например, Аβ(1-40)-пептид, который образует зрелые структуры разного типа (рис. 5), такие как "ветвящиеся", "спиральные" и "ленточные" (Goldsbury et al., 2000). Полиморфизм был показан и для других белков, таких как амилин (Goldsbury et al., 1997), кальцитонин (Bauer et al., 1995), инсулин (Jimenez et al., 2002).
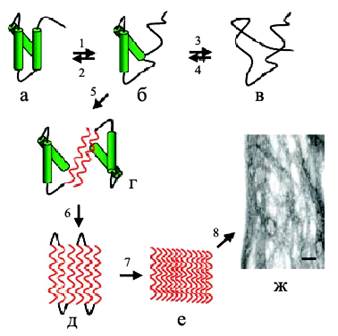
Рис. 4. Образование амилоидных фибрилл: (а) – нативная структура белка, (б) – промежуточное состояние, в котором части полипептидной цепи находятся в ненативной конформации, (в) – полностью развернутое состояние, (г) – образование межмолекулярного β-слоя, опосредованное развернутыми областями приводит к олигомеризации белка, (д) –дальнейшее образование β-складчатой структуры, (е) – образование протофибрилл, (ж) –формирование зрелых фибрилл (Jobansson, 2003).
Чемберлейн в 2000 г. показал, что фибриллы, образованные различными белками, обладают сходными структурными свойствами: все они образованы из протофибриллярных нитей, имеющих 2–5 нм в диаметре и содержащих от двух до пяти β-слоев. При этом размеры протофибрилл никак не связаны с количеством аминокислотных остатков белка-предшественника фибриллообразования. Так протофибриллы SH3 домена, включающего 90 аминокислотных остатков, состоят из двух β-слоев, а лизоцим, состоящий из 130 аминокислотных остатков, образует протофибриллярные нити, содержащие четыре β-слоя (Chamberlain et al., 2000).
2.4. Изучение амилоидных фибрилл invitro
Первоначально, амилоидные фибриллы изучали, выделяя их из пораженных амилоидных отложений. В настоящее время для изучения амилоидных фибрилл, а также амилоидогенеза их формируют in vitro. Открытие того, что амилоидные фибриллы формируют не только белки, связанные с амилоидозами, значительно расширило эту область исследования (Dobson, 1999). Было показано, что при подходящих условиях образовывать амилоидные фибриллы in vitro могут многие белки, такие как лизоцим, миоглобин, Аβ пептид, амилин, тау-белок, хангтингтин, мышечная ацилфосфатаза и др. (Uversky & Fink 2004).
Отмечено, что амилоидогенные белки обладают различными способностями к формированию амилоидов, что отражается также в различной скорости этого процесса. Например, мышечная ацилфосфатаза человека способна формировать аморфные агрегаты после первых часов инкубации и только через 45 дней появляются пучки фибрилл (Chiti et al., 1999) (рис. 6). Аβ(1-40)-пептид после 4 часов инкубации образует аморфные агрегаты, и только после 48 часов – длинные фибриллы (Qahwash et al., 2003), а образование фибрилл α-лактальбумина занимает несколько дней (Goers et al., 2002).
За скоростью амилоидогенеза наблюдают с помощью классического амилоидного красителя тиофлавина Т, который специфически взаимодействует с амилоидными фибриллами (Krebs et al., 2005). При взаимодействии тиофлавина Т с амилоидными фибриллами происходит увеличение интенсивности флуоресценции красителя при спектрофлуорометрических измерениях и наблюдается желто-зеленая флуоресценция при флуоресцентно-микроскопических исследованиях. Молекула красителя состоит из бензтиазольного и аминобензольного колец свободно вращающихся вокруг общей С–С связи. Кребс и соавторы показали, что молекула тиофлавина Т связывается с амилоидными фибриллами специфически (Krebs et al., 2005). Они предположили, что связывание происходит в "каналах", которые тянутся вдоль β-слоев (рис. 7). Более того, тиофлавин Т связывается с амилоидными фибриллами так, что их молекулы параллельны друг другу и расположены вдоль длинной оси фибриллы (Krebs et. al., 2005). Было показано, что причиной возрастания интенсивности флуоресценции тиофлавина Т при его связывании с амилоидными фибриллами является жесткость окружения, препятствующая повороту бензтиазольного и аминобензольного колец молекулы друг относительно друга в возбужденном состоянии (Воропай и др., 2003).
