Антиатеросклеротическое действие смеси масел льна и расторопши с селенопираном
С(нмоль/мл пл) = [(∆А* 106)/(2,2*105*1)]*[4/Vпроб], где: ∆А = Аоп - Афон, 2,2*105 – коэффициент экстинции, 1 (см) = L (толщина кюветы), 2 (мл) = Vгепт (объем гептана)
2.3.11. Определение содержания малонового диальдегида (МДА) в эритроцитах
За основу взят классический метод Ernster et al [25] в модификации для эритроцитов. 0,5 мл гемолизата эритроцитов (1:1) смешивают с 1 мл охлажденной 5% ТХУ и тщательно растирают смесь стеклянной палочкой. После выдерживают при 0±5 °С не менее 1-2 часов смесь центрифугируют при 4000 g 30 мин. Далее тщательно отбирают 0,4мл надосадка в пробирки для кипячения и добавляют 1,0 мл 0,5% тиобарбитуровой кислоты. Смесь инкубируют в кипящей воде более 10 мин после чего охлаждают и фотометрируют при 532 нм против соответствующего контроля. В расчет принимают коэффициент молярной экститнции – 1,56*105 см-1 М-1. С(нмоль/мл эр) = ∆А * 115,8
2.3.12. Определение содержания МДА в плазме крови и печени
За основу взят классический метод Mihara et al. [30]. 0,4 мл плазмы крови смешивают с 4 мл охлажденной 1,4% ортофосфорной кислоты и 2 мл 0,5% тиобарбитуровой кислоты. Смесь инкубируют в кипящей бане 45 мин после чего охлаждают и добавляют 4 мл н-бутанола. Смесь встряхивают до образования белой суспензии, после чего центрифугируют при 4000 g 20 мин. Верхнюю фазу фотометрируют при 532 нм против контрольной пробы. Коэффициент экстинции – 1,56*105 см-1 М-1. Формула для расчета (при L=1 см). С (нмоль/мл )= ∆А * 64,2
2.3.13. Определение жирнокислотного состава масел методом газожидкостной хроматографии (метод внутренней нормализации)
1 мл масла смешивают с 5 мл метанола, добавляют 1 мл метилирующего агента (раствор гидроксида тетраметиламмония) и 3 мл эфира серного (диэтиловый). Выдерживают в течение 10-15 мин при комнатной температуре, аликвотную часть отбирают для анализа (3-5 мкл) и хроматографируют.
Режим разделения: Температура колонки 170-190°С, Температура впрыскивающей камеры 250°С, Колонка насадочная 3 м, Содержание колонки: 5% диэтиленгликольсукцинат нанесенный на хроматон N-AW. Анализ проводят относительно количества жирных кислот.
2.3.14. Гистологический анализ
Выполняли для подтверждения наличия атеросклеротических изменений в опытных группах. Для гистологического исследования брали грудную и брюшную аорту, фиксировали 10% нейтральным формалином. Гистологическое исследование выполняли сотрудники гистологической лаборатории.
3. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
3.1. ИССЛЕДОВАНИЯ АНТИОКСИДАНТНЫХ СВОЙСТВ СЕЛЕНОПИРАНА
Данные исследования антиоксидантных свойств СП по сравнению с БОТ, ТФ и СП при термическом окислении подсолнечного масла (Таблица 1) свидетельствуют о том, что антиоксидантная активность СП не уступает активности БОТ, и даже превосходит ее.
Рисунок 1
Динамика накопления пероксидов в смеси нерафинированных растительных масел в присутствии бутилокситолуола, селенопирана и токоферола
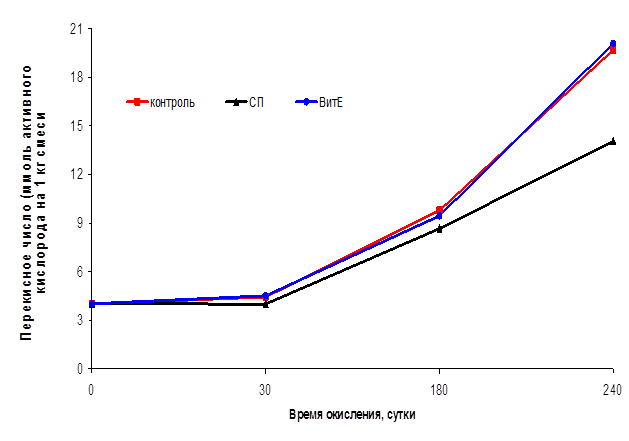
Преимущество СП становится заметным уже в течение 1-го часа окисления. Отмечено, что введение в смесь СП приводило к снижению концентрации пероксидов, и только к 6 часу их накопление достигло величин, превышающих исходные. К 26 часу окисления концентрация пероксидов в системе с БОТ составляла 95,65%, с СП – 85,51%, с ТФ – 111,6% по отношению к контролю.
Таблица 1
Динамика накопления пероксидов в подсолнечном масле в присутствии бутилокситолуола, селенопирана и токоферола
|
Часы |
Концентрация пероксидов, ммоль/г | |||
|
контроль |
БОТ |
СП |
ТФ | |
|
0 |
0,0060 |
0,0060 |
0,0060 |
0,0060 |
|
1 |
0,0090 |
0,0070 |
0,0045 |
0,0060 |
|
3 |
0,0100 |
0,0080 |
0,0055 |
0,0100 |
|
6 |
0,0131 |
0,0130 |
0,0090 |
0,0170 |
|
11 |
0,0300 |
0,0250 |
0,0210 |
0,0280 |
|
18 |
0,0480 |
0,0460 |
0,0380 |
0,0520 |
|
26 |
0,0690 |
0,0660 |
0,0590 |
0,0770 |
При щадящем режиме окисления смеси растительных масел СП в качестве АО также имел преимущества перед ТФ (Рис. 1), что позволило выбрать его для стабилизации итогового продукта – композиции нерафинированных масел льна и расторопши.
3.2. ИЗМЕНЕНИЯ БИОХИМИЧЕСКИХ ПОКАЗАТЕЛЕЙ ТКАНЕЙ ЭКСПЕРИМЕНТАЛЬНЫХ ЖИВОТНЫХ
Результаты комплексного биохимического и гистологического анализа биоматериала, полученного от экспериментальных животных, свидетельствуют о существенном торможении развития атеросклеротических процессов при введении СМЛР в качестве добавки к ВЖР.
Достоверные различия между опытными группами обнаруживались как в количестве липидов плазмы крови, так и в их соотношении (Таблица 2). В первой опытной группе наблюдались характерные признаки нарушения липидного обмена: повышение ХСобщ на 54% и ХС-ЛНП на 350 % по сравнению с контрольной группой, на фоне снижения содержания ХС-ЛВП на 57 %. При этом ИА повышался до 6,29 по сравнению с 1,03 в контроле. Введение в ВЖР животных второй опытной группы СМЛР привело к торможению накопления в плазме ХС, снижение на 38 % и снижение концентрации ХС атерогенных ЛП: ХС-ЛНП на 272% и ХС-ЛОНП на 55% по сравнению с контролем, а также к повышению содержания ХС-ЛВП 42%, что отразилось на величине ИА – 3,91.
