Физико-химические методы определения фенола
3. Химические свойства
Обладает слабыми кислотными свойствами, при действии щелочей образует соли – феноляты.

– Вступает в реакции электрофильного замещения по ароматическому кольцу. Гидрокси-группа, являясь одной из самых сильных донорных групп, увеличивает реакционную способность кольца к этим реакциям, и направляет замещение в орто- и пара-положения. Фенол с лёгкостью алкилируется, ацилируется, галогенируется, нитруется и сульфируется.
– Реакция Кольбе-Шмидта.
3.1 Реакции по гидроксильной группе
Углерод-кислородная связь в фенолах гораздо прочнее, чем в спиртах. Например, фенол не может быть превращен в бромбензол действием на него бромоводорода, тогда как циклогексанол при нагревании с бромоводородом легко превращается в бромциклогексан:
![]()

Как и алкоксиды феноксиды реагируют с алкилгалогенидами и другими алкилирующими реагентами с образованием смешанных эфиров:

Фенетол

Анизол
Алкилирование фенолов галогенуглеводородами или диметилсульфатом в щелочной среде представляет собой модификацию реакции Вильямсона. По реакции алкилирования фенолов хлоруксусной кислотой получают такие гербициды как 2,4 – дихлорфеноксиуксусная кислота (2,4 – Д).

2,4 – Дихлорфеноксиуксусная кислота (2,4 – Д)
и 2,4,5 – трихлорфеноксиуксусная кислота (2,4,5 – Т).

2,4,5 – трихлорфеноксиуксусная кислота (2,4,5 – Т)
Исходный 2,4,5 – трихлорфенол получают по схеме:

1,2,4,5 – Тетрахлорфенол 2,4,5 – трихлорфеноксид натрия 2,4,5 – трихлорфенол
При перегреве на стадии получения 2,4,5 – трихлорфенола вместо него может образовываться очень токсичный 2,3,7,8 – тетрахлордибензодиоксин:

2,3,7,8 – Тетрахлордибензодиоксин
Фенолы являются более слабыми нуклеофилами, чем спирты. По этой причи-не они в отличие от спиртов не вступают в реакцию этерификации. Для получения сложных эфиров фенолов используют хлорангидриды и ангидриды кислот:

Фенилацетат

Дифенилкарбонат
3.2 Замещение в кольцо
Оксигруппа фенола очень сильно активирует ароматическое кольцо по отношению к реакциям электрофильного замещения. В качестве промежуточных соединений вероятнее всего образуются оксониевые ионы:


При проведении реакции электрофильного замещения в случае фенолов необходимо применять специальные меры для того, чтобы предотвратить полизамещение и окисление.
3.3 Нитрование
Фенол нитруется гораздо легче бензола. При действии на него концентрированной азотной кислоты образуется 2,4,6 – тринитрофенол (пикриновая кислота):

Пикриновая кислота
Наличие в ядре трех нитрогрупп резко увеличивает кислотность фенольной группы. Пикриновая кислота является, в отличие от фенола, уже довольно сильной кислотой. Наличие трех нитрогрупп делает пикриновую кислоту взрывчатой, она используется для приготовления мелинита. Для получения мононитрофенолов необходимо использовать разбавленную азотную кислоту и проводить реакцию при низких температурах:

Получается смесь о- и п-нитрофенолов с преобладанием о-изомера. Эта смесь легко разделяется благодаря тому, что только о-изомер обладает летучестью с водяным паром. Большая летучесть о-нитрофенола объясняется образованием внутримолекулярной водородной связи, в то время как в случае п-нитрофенола возникает межмолекулярная водородная связь.


3.4 Сульфирование
Сульфирование фенола осуществляется очень легко и приводит к образованию в зависимости от температуры преимущественно орто- или пара-фенолсульфокислот:

3.5 Галогенирование
Высокая реакционная способность фенола приводит к тому, что даже при его обработке бромной водой происходит замещение трех атомов водорода:

Для получения монобромфенола необходимо принимать специальные меры.

п-Бромфенол
3.6 Реакция Кольбе
Диоксид углерода присоединяется к феноксиду натрия по реакции Кольбе, представляющей собой реакцию электрофильного замещения, в которой электрофилом является диоксид углерода

Фенол Феноксид натрия Салицилат натрия Салициловая кислота
Механизм:

Действием на салициловую кислоту уксусного ангидрида получают аспирин:

Ацетилсалициловая кислота
Если оба орто-положения заняты, то замещение проходит по пара-положению:
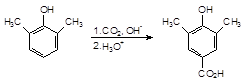
Реакция проходит по следующему механизму:


3.7 Конденсация с карбонилсодержащими соединениями
При нагревании фенола с формальдегидом в присутствии кислоты образуется фенолформальдегидная смола:

Фенолформальдегидная смола
Конденсацией фенола с ацетоном в кислой среде получают 2,2 – ди (4-гидроксифенил) пропан, получивший промышленное название бисфенол:

Бисфенол
2,2 – ди (4-гидроксифенил) пропан-ди (4-оксифенил) диметилметан
Обработкой бисфенола фосгеном в пиридине получают лексан:

Лексан
В парисутствии серной кислоты или хлорида цинка фенол конденсируется с фталевым ангидридом с образованием фенолфталеина:

