Витамин С - структура, химические свойства, значение
1.3.3 Инфракрасная спектроскопия
В ИК-спектре L-аскорбиновой кислоты имеется ряд интересных
максимумов поглощения.(рис.3.9)


Особенный интерес представляет область валентных колебаний
О—Н от 4000 до 2000 см -1 (рис.3.10).
Так как длины водородных связей (и соответственно прочность) в кристалле известны, можно провести корреляцию этих максимумов поглощения и характеристических валентных колебаний ОН-групп, участвующих в образовании водородных связей. Очевидно, что четыре отчетливых пика в высокочастотном крыле спектра соответствуют спиртовым ОН-группам при С-5 и С-6 боковой цепи (табл. 3.3).

Енольные гидроксилы при С-2 и С-3 участвуют в образовании более прочных водородных связей с укороченным расстоянием О-О (0,261-0,267 нм), что выражается в виде сложной серии уширенных полос в области 3100-2200см -1, соответствующих молекулам А и В. Несомненно, пик с максимумом поглощения 2915 см -1 вблизи высокочастотного крыла спектра является следствием наложения сигналов валентных колебаний С-Н. Что касается низкочастотных сигналов, сильное поглощение при 1754 см -1 было отнесено за счет валентных колебаний группы С=О пятичленного лактонного кольца, а интенсивный дублет при 1675 и 1660 см -1 — за счет валентных колебаний группы С=С (на которые накладываются колебания вдоль всей сопряженной системы). Сигнал при 1460 см -1 приписан ножничным колебаниям группы СН2 .
Несмотря на сложность области характеристических колебаний, были сделаны попытки провести их корреляции, например:
полоса при 1320 см -1 приписана деформации С-2-ОН, полоса при 1275 см -1 — колебаниям С-2—О, полоса при 1140 см -1 — колебаниям С-5—О и полосы при 1025/990 см -1 — деформации лактонного кольца.
1.3.4 Спектроскопия ядерного магнитного резонанса
В спектре 13С ЯМР L-аскорбиновой кислоты при полном подавлении спин-спинового взаимодействия с протонами, как и ожидалось, появились сигналов, которые были соотнесены с конкретными атомами молекулы (рис. 3.11).

Неполное подавление спин-спинового взаимодействия с протонами приводит к ожидаемому расщеплению сигналов, т. е. С-1, С-2 и С-3 (синглеты), С-4 и С-5 (дуплеты) и С-6 (триплет). Сигналы С-4 и С-5 удалось дифференцировать после того, как был получен спектр при полном подавлении спин-спинового взаимодействия с протонами производного, дейтерированного по положению 4, где сигнал при 77δ м. д. стал триплетом вследствие спин-спинового взаимодействия с дейтерием. Сигнал С-3 был идентифицирован благодаря его большому (19δ м. д.) слабопольному сдвигу при изменении рН от 2 до 7, что приводит к депротонированию С-3—ОН. Особенно интересен спектр 1Н ЯМР L-аскорбиновой кислоты, так как его тщательный анализ позволяет определить конформацию молекулы в водном растворе. При снятии спектра в D2O четыре протона ОН-групп замещаются на дейтерий и не проявляются в виде сигналов. Остальные четыре протона (Н-6, Н-6', Н-5 и Н-4) образуют систему АВМХ, причем протоны при С-6 неэквивалентны из-за хиральности атома С-5.
Тонкая структура этих сигналов не проявляется в низких магмагнитных полях (60 или 100 МГц), но выше 300 МГц обнаруживается спин-спиновое взаимодействие, не являющееся взаимодействием первого порядка. Это расщепление особенно заметно в спектре 1Н ЯМР аскорбата натрия (рис. 3.12).
Значения констант спин-спинового взаимодействия J, полученные из таких спектров, позволяют определить преимущественную конформацию L-аскорбиновой кислоты в водном растворе. Например, найдено, что Jh4,H5 составляет 1,8 Гц. Это соответствует предсказанному значению для конформации, изображенной на рис. 3.13. Таким образом, преимущественная конформация вокруг связи С-4—С-5 в водном растворе такая же, как и в кристалле (рис. 3.8).
В равной степени информативна корреляция констант спин-спинового взаимодействия с конформацией вокруг связи С-5—С-6.
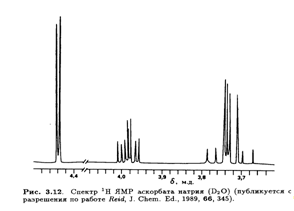


Возможные стабильные конформеры представлены на рис. 3.14. Предположив, что наблюдаемые константы спин-спинового взаимодействия являются весовым усреднением теоретических величин для трех конформеров, можно вычислить их населенность (табл. 3.4). И снова предпочтительная конформация вокруг связи С-5—С-6 в растворе идентична обнаруженной в кристалле. Сходство преимущественных конформации боковых цепей в кристаллической решетке и в растворе объясняется, возможно, отсутствием в обоих случаях внутримолекулярных водородных связей. Но, конечно, прочные межмолекулярные водородные связи образуются между соседними молекулами аскорбиновой кислоты в кристалле и с молекулами воды в водном окружении.
1.3.5Масс-спектрометрия
В масс-спектре L-аскорбиновой кислоты, зафиксированном при ионизации молекулы под действием электронного удара, имеется интенсивный пик с m/е 116 наряду с пиком молекулярного иона (m/е 176) (рис. 3.15). Было высказано предположение, что фрагментация происходит за счет отщепления боковой цепи с последующим разрушением кольца, что соответствует наличию наиболее интенсивных сигналов (рис. 3.16).



2 Химические свойства l-аскорбиновой кислоты
Некоторые превращения L-аскорбиновой кислоты уже упоминались в разделе, посвященном установлению структуры молекулы.
Эти и другие реакции будут подробно рассмотрены в последующих разделах.
2.1 Алкилирование и ацилирование
Как и у многих углеводов, первичный гидроксил при С-6 L-аскорбиновой кислоты легко подвергается трифенилметилированию (тритилированию) под действием трифенилхлорметана в пиридине (рис. 4.8).

Метилирование L-аскорбиновой кислоты диазометаном проливает свет на таутомерную природу витамина. Повышенная кислотность гидроксила при С-3 позволяет оттитровать его диазометаном в эфире; при этом образуется
3-О-метиласкорбиновая кислота. Реакция сопровождается образованием небольших количеств 1-метил-ψ-L-аскорбиновой кислоты вследствие присутствия минорных количеств таутомера. Оба соединения подвергаются дальнейшему етилированию диазометаном,давая 2,3-ди-О-метил-L-аскорбиновую и 1,2-ди-O-метил- ψ-L-аскорбиновую кислоту соответственно (рис. 4.9)
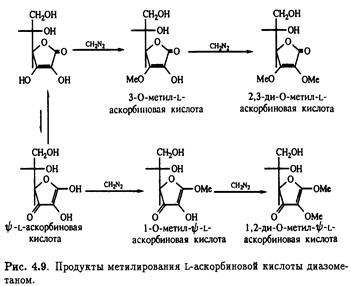
Под действием щелочи с последующим подкислением 2,3-ди-О-метильное производное претерпевает интересную цепь превращений. Образуется не простой моноциклический лактон, а бициклическое производное с единственным свободным гидроксилом — 2,3-изодиметил-L-аскорбиновая кислота. Кислотный гидролиз этого продукта приводит к 3-О-метил-L-аскорбиновой кислоте, которая также получается при стоянии на холоду водного раствора 1,2-ди- O-метил- ψ-L- аскорбиновой кислоты, что сопровождается потерей лабильного метильного остатка при С-1. Как и следовало ожидать, 3-O-метил-L-аскорбиновая кислота легко метилируется под действием диазометана в эфире, образуя 2,3-ди-О-метилированное производное. Описанные превращения суммированы на рис. .10.
