Страница
4
Атом железа может образовать шесть координационных связей. Четыре связи направлены к атомам азота пиррольных колец, оставшиеся две связи –
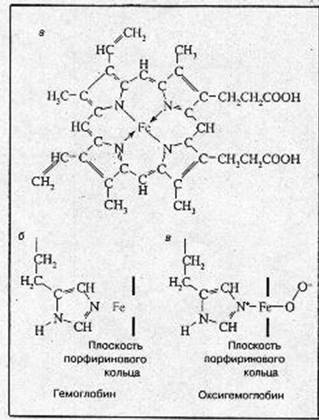
Рис.1. Структура гема (а), структура активного центра дезоксигемоглобина (б), структура активного центра оксигемоглобина (в).
перпендикулярно к плоскости порфиринового кольца по обе его стороны. Гемы расположены вблизи поверхности белковой глобулы в специальных карманах, образованных складками полипептидных цепочек глобина. Гемоглобин при нормальном функционировании может находиться в одной из трех форм: феррогемоглобин (обычно называемый дезоксигемоглобином или просто гемоглобином), оксигемоглобин и ферригемоглобин (называемый также метгемоглобином). В феррогемоглобине железо находится в закисной форме Fe(II), одна из двух связей, перпендикулярных к плоскости порфиринового кольца, направлена к атому азота гистидинового остатка, а вторая связь свободна (рис.1, б). Кроме этого гистидинового остатка, называемого проксимальным (соседним), по другую сторону порфиринового кольца и на большем расстоянии от него находится другой гистидиновый остаток — дистальный гистидин, не связанный непосредственно с атомом железа. Взаимодействие молекулярного кислорода со свободным гемом приводит к необратимому окислению атома железа гема [Fe(II) Þ Fе(III); гем Þ гемин]. В дезоксигемоглобине глобин предохраняет железо гема от окисления.
Реакция оксигенации Обратимое присоединение кислорода (оксигенация), позволяющее гемоглобину выполнять свою основную функцию переносчика, обеспечивается возможностью образовать прочные пятую и шестую координационные связи и перенести электрон на кислород не от железа (то есть окислить Fe2+), а от имидазольного кольца проксимального гистидина. Это схематически изображено на рис.1, б. Вместо молекулярного кислорода железо гема может присоединить окись углерода СО (угарный газ). Даже небольшие концентрации СО приводят к нарушению кислородпереносящей функции гемоглобина и отравлению угарным газом.
Выше было сказано, что одна молекула гемоглобина содержит четыре субъединицы и, следовательно четыре гема, каждый из которых может обратимо присоединить одну молекулу кислорода. Поэтому реакцию оксигенации можно разделить на четыре стадии:
Hb+O2 Û HbO2 (1a)
НbO2+O2 Û Hb(O2)2 (1б)
Hb(O2)2+O2 Û Hb(O2)3 (1в)
Hb(O2)3+O2 Û Hb(O2)4 (1г)
Прежде чем рассмотреть эту главную функциональную реакцию гемоглобина более детально, необходимо сказать несколько слов о мышечном гемоглобине — миоглобине. Этот красящий белок поперечнополосатых мышц представляет собой комплекс гема с "четвертушкой" глобина. Он содержит одну молекулу гема и одну полипептидную цепочку, состав и структура которой подобны составу и структуре b-субъединицы гемоглобина. Как и для гемоглобина, важнейшей функцией миоглобина является обратимое присоединение молекулярного кислорода. Эту функцию характеризует так называемая кривая оксигенации, связывающая степень насыщения гемоглобина кислородом (в процентах) с парциальным давлением последнего, рО2 (мм Hg). Типичные кривые оксигенации гемоглобина и миоглобина (при условии достижения химического равновесия) приведены на рис.2, а, б. Для миоглобина кривая является гиперболой, как и должно быть в случае одностадийной химической реакции при условии достижения химического равновесия:
Mb+O2ÛMbO2 (2)
где Mb - миоглобин.
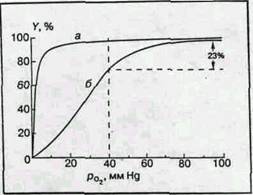
Рис. 2 Кривые оксигенации
миоглобина (а) и гемоглобина (б)
Совершенно другая картина возникает в случае гемоглобина. Кривая диссоциации имеет S-образную форму. Без кислорода молекулы гемоглобина обладают низким сродством к кислороду и равновесие реакции (1а) сдвинуто влево. Затем кривая становится круче и при высоких значениях рО2 практически сливается с кривой диссоциации миоглобина. [2]
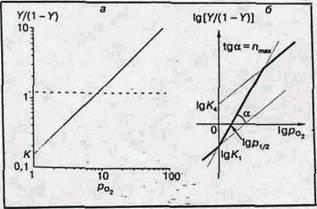
Рис. 3. Логарифмические анаморфозы кривых оксигенации миоглобина (a) и гемоглобина (б)
М.Перутц пишет, что распределение молекул кислорода по молекулам гемоглобина следует библейской притче: "Каждому, у кого есть, дай еще, и у него будет избыток; у того же, у кого нет, забери то немногое, что у него осталось". Это заставляет предположить, что между гемами одной молекулы гемоглобина существует некоторая связь, благодаря которой присоединение кислорода к одному гему влияет на присоединение кислорода к другому гему той же молекулы. Это явление было известно задолго до работ Перутца и установления структуры гемоглобина и механизма его реакции с кислородом. Оно получило название гем-гем взаимодействия. Физиологический смысл гем-гем взаимодействия очевиден. Сигмоидная форма кривой диссоциации создает условия максимальной отдачи кислорода при переносе гемоглобина от легких с высоким значением pO2 к тканям с низким значением pO2. Для человека значения pO2 артериальной и венозной крови в нормальных условиях (Т 37°С, pH 7,4) равны соответственно 100 и 40 ммHg. При этом (рис.2, б) гемоглобин отдает тканям 23% связанного кислорода (степень оксигенации меняется от 98 до 75%). При отсутствии гем-гем взаимодействия для одногемового миоглобина (рис.2, а) эта величина не превышает 5%. Миоглобин поэтому служит не переносчиком, а депо кислорода и отдает его мышечной ткани лишь при резкой гипоксии, когда насыщение ткани кислородом падает до недопустимо низкого значения. [2]
Логарифмическая анаморфоза кривой диссоциации гемоглобина человека представлена на рис.3, б. В этом случае начало кривой представляет собой прямую под углом 45° к координатным осям, как и для миоглобина: первые молекулы кислорода соединяются в основном с молекулами гемоглобина, еще не содержащими кислорода, и гемы таким образом оксигенируются независимо. Это свидетельствуют о том, что гем-гем взаимодействие обусловлено не просто наличием нескольких гемов в молекуле, а тем, что после оксигенации одного гема меняются условия оксигенации других гемов той же молекулы. Затем наклон кривой увеличивается. Тангенс угла максимального наклона получил название коэффициента Хилла (n), который отражает степень кооперативности процесса. Для миоглобина n=1, а для гемоглобина человека (в норме) n~3. Вблизи области полного насыщения гемоглобина кислородом наклон кривой снова становится равным 45° (большинство молекул гемоглобина либо не содержат свободных гемов, либо имеют лишь один гем, способный присоединить кислород).
Механизм кооперативности В 1963 году Моно, Шанже и Джекоб обнаружили, что активность некоторых ферментов меняется скачком между двумя значениями при воздействии на белок некоторых низкомолекулярных агентов, не принимающих участия непосредственно в каталитическом акте. Такие ферменты получили название аллостерических, а само явление – аллостерии. Предполагается, что эти ферменты могут находиться в разных состояниях, переключение между которыми осуществляется при присоединении специфического низкомолекулярного лиганда (необязательно вблизи активного центра). В 1965 году Моно, Уайман и Шанже поняли, что гемоглобин, не являясь ферментом, принадлежит к тому же классу белков. К тому времени уже было известно, что структуры глобул оксигемоглобина и гемоглобина различны, и авторы предположили, что состояния с разными значениями констант оксигенации соответствуют различным пространственным структурам белка. Для гемоглобина постулируется наличие двух таких состояний: R (от англ. relaxed) и Т (от англ. tense). Состояние R характеризуется высоким, а Т – низким сродством к О2 (сильнее и слабее связывают молекулярный кислород соответственно). В рамках этой концепции считается, что как в R-, так и в Т-состоянии сродство к кислороду субъединиц одной глобулы (т.е. есть всех четырех гемов одной глобулы) одинаково. Этот постулат позволяет построить сравнительно простую математическую модель кооперативных свойств гемоглобина: КR, КТ и L (константы равновесия реакций ассоциации в состояниях R, Т и отношение числа молекул гемоглобина в состояниях Т и R соответственно). На рис.2, б ясно, что КТ<КR. Очевидно, увеличение константы ассоциации при переходе из состояния Т в состояние R соответствует в расчете на один гем изменению свободной энергии системы
