Энергетика химических процессов
Уравнения химических реакций с указанием тепловых эффектов называют термохимическими уравнениями.
Термохимическое уравнение реакции синтеза 1 моля воды имеет вид:
![]() .
.
В термохимических уравнениях указывается также агрегатное состояние и полиморфная модификация реагирующих и образующихся веществ: г – газовое, ж – жидкое, к – кристаллическое и т.д.
В основе термохимических расчетов лежит закон, сформулированный Гессом Г.И. (1841):
Тепловой эффект зависит только от вида (природы) и состояния исходных веществ и конечных продуктов, но не зависит от пути процесса, т.е. от числа и характера промежуточных стадий.
Так, образование оксида углерода (IV) из графита и кислорода можно рассматривать или как непосредственный результат взаимодействия простых веществ:
![]() ,
,
или как результат процесса, протекающего через промежуточную стадию образования и сгорания оксида углерода (II):
![]()
или суммарно
![]()
Согласно закону Гесса, тепловые эффекты образования СО2 как непосредственно из простых веществ, так и через промежуточную стадию образования и сгорания СО равны
![]() .
.
По приведенному равенству нетрудно вычислить одну из величин DН, зная две другие. Как известно, тепловые эффекты образования СО2 (DН1) и горения СО (DН3) определяются экспериментально. Тепловой же эффект образования СО (DН2) измерить невозможно, т.к. при горении углерода в условиях недостатка кислорода образуется смесь СО и СО2. Но теплоту образования СО можно рассчитать по известным значениям ![]() и
и ![]() :
: ![]() ;
; ![]() .
.
Следствия из закона Гесса:
Тепловой эффект обратной реакции равен тепловому эффекту прямой реакции с обратным знаком, т.е. для реакций
![]()
отвечающие им тепловые эффекты ![]() связаны равенством
связаны равенством
![]() .
.
Если в результате ряда последовательных химических реакций система приходит в состояние, полностью совпадающее с исходным (круговой процесс), то сумма тепловых эффектов этих реакций равна нулю, т.е. для ряда реакций

сумма их тепловых эффектов
![]() .
.
В термохимических расчетах широко используют энтальпии (теплоты) образования веществ.
Под энтальпией образования понимают тепловой эффект реакции образования 1 моля вещества из простых веществ. Обычно используют стандартные энтальпии образования. Их обозначают ![]() или
или ![]() (часто один из индексов опускают; f – от англ. formation).
(часто один из индексов опускают; f – от англ. formation).
Стандартные энтальпии образования простых веществ, устойчивых в стандартных условиях (газообразный кислород, жидкий бром, кристалллический иод, ромбическая сера, графит и т.д.), принимают равными нулю.
Согласно закону Гесса тепловой эффект реакции равен сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ. Для реакций вида
![]()
тепловой эффект DНх.р. определяется равенством
![]()
или
![]() .
.
Примеры.
Для реакции взаимодействия кристаллического оксида алюминия и газообразного оксида серы (VI)
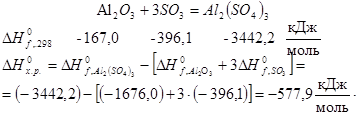
Реакция термического разложения СаСО3:
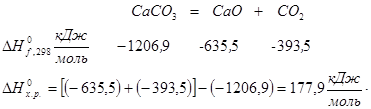
3. Реакция разложения бертолетовой соли

Энтальпии образования известны примерно для 4000 веществ в различных агрегатных состояниях. Это позволяет чисто расчетным путем установить энергетические эффекты самых разнообразных процессов.
Большинство процессов представляет собой два одновременно происходящих явления: передачу энергии и изменение в упорядоченности расположения частиц относительно друг друга.
Частицам (атомам, ионам) присуще стремление к беспорядочному движению, поэтому система стремится перейти из более упорядоченного состояния в менее упорядоченное.
Так, если, например, баллон с газом соединить с сосудом, то газ из баллона будет распределяться по всему объему сосуда. При этом система из более упорядоченного состояния (с меньшим беспорядком) переходит в состояние менее упорядоченное (с большим беспорядком).
Количественной мерой беспорядка является энтропия S.
Или другими словами: энтропия – мера неупорядоченности системы. Ее представляют как логарифмическое выражение вероятности существования вещества или различных его форм:
![]() ,
,
где S – энтропия, ![]() - коэффициент пропорциональности (к – постоянная Больцмана), W – термодинамическая вероятность существования вещества или какой-либо его формы, т.е. число возможных микросостояний, соответствующих данному макросостоянию вещества.
- коэффициент пропорциональности (к – постоянная Больцмана), W – термодинамическая вероятность существования вещества или какой-либо его формы, т.е. число возможных микросостояний, соответствующих данному макросостоянию вещества.
При переходе системы из более упорядоченного состояния в менее упорядоченное энтропия возрастает (DS > 0). Чтобы оценить изменение энтропии при переходе из состояния 1 в состояние 2 необходимо, как обычно, из величины какого-либо свойства, характеризующего конечное состояние, вычесть величину того же свойства, характеризующего начальное состояние:
![]()
II закон термодинамики: в изолированных системах энтропия самопроизвольно протекающего процесса возрастает, т.е. DS > 0.
Переход же системы из менее упорядоченного состояния в более упорядоченное связан с уменьшением энтропии, и самопроизвольное протекание подобного процесса менее вероятно. Так, ясно, что в рассматриваемом примере невероятно, чтобы газ самостоятельно собрался в баллоне.
В случае перехода системы из менее упорядоченного состояния в более упорядоченное энтропия системы уменьшается (DS < 0).
Нетрудно понять, что энтропия возрастает при переходе жидкости в пар, при растворении кристаллического вещества, при расширении газов и т.д. Во всех этих случаях наблюдается уменьшение порядка в относительном расположении частиц. Наоборот, в процессах конденсации, кристаллизации веществ энтропия уменьшается.
