Центральная нервная система взрослого млекопитающего
Ярким примером регенерации нервной системы является анатомическая и функциональная интеграция трансплантированных эмбриональных клеток Пуркинье мозжечка у взрослой мутантной мыши с дегенерацией собственных клеток Пуркинье (рис. 5.). Сотело и его коллеги трансплантировали диссоциированные клетки Пуркинье либо целые кусочки эмбриональной ткани в мозжечок взрослой мутантной мыши. Донорские клетки Пуркинье мигрировали из трансплантанта в зоны, где исходно располагались дегенерировавшие впоследствии клетки Пуркинье. Они продвигались вдоль глиальных клеток Бергмана, в которых была индуцирована экспрессия белков, управляющих движением донорских клеток Пуркинье. Через 2 недели многие трансплантированные клетки формировали дендритные деревья, похожие на разветвления обычных клеток Пуркинье, лиановидные волокна образовывали синапсы сначала на клеточном теле, затем на проксимальных дендритах, а параллельные волокна иннервировали дистальные дендриты. Характерные синаптические потенциалы были зарегистрированы после стимуляции входов лиановидных и мшистых волокон. Тем не менее имплантированные клетки редко устанавливали синаптические связи с их обычными мишенями в глубоких ядрах мозжечка. Вместо этого они стремились установить связи с донорскими нейронами, перенесенными и выжившими в составе трансплантанта. Несмотря на это, проведенные эксперименты демонстрируют, что трансплантированные нервные клетки могут в значительной мере интегрироваться в нейрональную сеть взрослого организма.
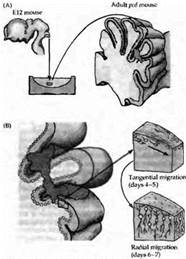
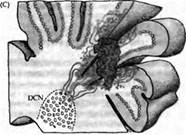
Рис. 5. Реконструкция нейрональной сети мозжечка трансплантацией мозговой ткани эмбриона во взрослую мутантную мышь (pcd), y которой клетки Пуркинье дегенерируют вскоре после рождения. (А) Цельные участки мозжечковой ткани от 12-дневного эмбриона (Е12) были инъецированы в мозжечок 2-4-месячных pcd мышей. (В) К 4-5 дню после трансплантации клетки Пуркинье мигрировали от трансплантанта по линии, касательной к мозговой поверхности. Через 6-7 дней после трансплантации клетки Пуркинье начинали мигрировать в радиальном направлении внутрь ткани мозжечка по глиальным клеткам Бергмана, пронизывая молекулярный слой. (С) Донорские клетки Пуркинье, находящиеся на расстоянии не более 600 мкм от глубинных ядер мозжечка (ГЯМ) реципиента, тянут аксоны к ГЯМ и формируют синаптический контакт на специфических мишенях. Те же донорские клетки Пуркинье, которые располагаются на большем расстоянии, контактируют преимущественно с донорскими же клетками ГЯМ, попавшими сюда вместе с трансплантантом.
Ясно, что многое нейроны ЦНС млекопитающих сохраняют даже во взрослом состоянии удивительную способность к регенерации аксонов и дендритов и восстановлению соответствующих синаптических связей. Главной причиной несостоятельности регенерации после большинства повреждений ЦНС является ингибирование врожденных регенеративных возможностей факторами, производимыми глиальными клетками и трофическими молекулами, влияющими на рост нейронов. Идентификация механизмов подавления эндогенных тормозных факторов является областью активных научных исследований, так же как и изучение нейрональных стволовых клеток, представляющих собой потенциальный источник новых глиальных клеток и нейронов, чьи свойства могут быть адаптированы методами генной инженерии. Успехи в этой области в сочетании с развитием трансплантационной техники дают надежду на восстановление функционального дефицита, возникающего в результате повреждений и нейродегенеративных заболеваний ЦНС.
Выводы
∙ При перерезке аксона в нервной системе позвоночных происходит дегенерация дистального отдела нерва. Аксотомированная клетка либо подвергается хроматолизу, либо погибает.
∙ Многие пресинаптическиетерминали, иннервирующие аксотомированные нейроны, подвергаются ретракции; оставшиеся окончания освобождают сниженное количество квантов нейротрансмиттера.
∙ В денервированных скелетных мышечных волокнах в экстрасинаптических участках происходит синтез и экспрессия новых АХ рецепторов, что делает мышцу гиперчувствительной к АХ. Денервированные нейроны также становятся гиперчувствительными к трансмиттерам, освобождающимся из поврежденных синаптических аксонов.
∙ Мышечная активность является важным фактором, определяющим количество АХ рецепторов и их распределение. Мышечная активность влияет также на скорость деградации и восстановления АХ рецепторов.
∙ У взрослых млекопитающих или лягушки иннервированная мышца не принимает иннервации дополнительным нервом. В отличие от этого, нервные волокна способны формировать новые синапсы на денервированных или поврежденных мышечных волокнах.
∙ Частично денервированные мышцы и нейроны способны вызвать рост новых разветвлений у неповрежденных близлежащих нервов и формирование новых синапсов.
∙ Шванновские клетки периферической нервной системы обеспечивают особое окружение нейронов, стимулирующее рост аксонов.
∙ Синаптический участок базальной мембраны, окружающий мышечные волокна, ассоциирован с таким фактором, как агрин, который индуцирует синаптические специализации в регенерирующих окончаниях аксонов и мышечных волокнах. Агрин является протеогликаном, синтезирующимся двигательными нейронами и освобождающимся из окончаний их аксонов. После выделения он становится ассоциированным с синаптической базальной мембраной и индуцирует формирование пре- и постсинаптических специализаций.
∙ Центральная нервная система взрослых млекопитающих обладает ограниченными возможностями для регенерации.
∙ Шванновские клетки в форме периферического нервного трансплантанта или инъецированные как клеточная суспензия в зону повреждения создают благоприятное окружение для роста аксонов нейронов ЦНС млекопитающих.
∙ В ЦНС эмбрионов и новорожденных млекопитающих способна происходить эффективная регенерация после повреждения Нейроны эмбрионов или новорожденных животных, так же как и нейроны и глиальные клетки, происходящие от нейрональных стволовых клеток, выживают и растут при трансплантации в ЦНС взрослого млекопитающего. Трансплантированные клетки могут быть интегрированы в существующие нейрональные сети и частично восстанавливать утерянную функцию.
