Центральная нервная система взрослого млекопитающего
Не все нейроны ЦНС даже в благоприятном окружении способны удлинять аксоны. Например, при перерезке аксонов клеток Пуркинье мозжечка у взрослых животных выживают все утратившие отростки нейроны, но это не сопровождается регенерацией аксонов, даже если в поврежденный участок имплантируются кусочки эмбрионального мозжечка. Между тем такие имплантанты эффективно стимулируют прорастание аксонов других мозжечковых нейронов. Таким образом, регенерация зависит как от условий, разрешающих или активирующих рост нервных клеток, так и от внутренних характеристик, присущих данному нейрону. Отсутствие способности к регенерации поврежденных отростков у клеток Пуркинье коррелирует с тем, что в их цитоплазме при аксотомии не происходит повышения синтеза белков, обеспечивающих рост аксонов.
Формирование синапсов при регенерации аксонов в ЦНС млекопитающих
Могут ли аксоны, регенерирующие в ЦНС млекопитающих, правильно находить свои мишени и создавать функционирующие синапсы? Эксперименты на регенерирующих аксонах ганглиозных клеток сетчатки дали положительный ответ на этот вопрос. Если после перерезки зрительного нерва в поврежденный участок между глазом и верхним четверохолмием вставляли мостик, состоящий из периферического нерва, аксоны ганглиозных клеток сетчатки прорастали через мост, достигали своей цели, ветвились и образовывали синапсы (рис. 3.). Под электронным микроскопом регенерированные синапсы, образованные в должных участках клеток-мишеней имели нормальную структуру, и являлись функционирующими, о чем свидетельствовало то, что освещение глаза вызывало генерацию электрических сигналов в постсинаптических клетках.
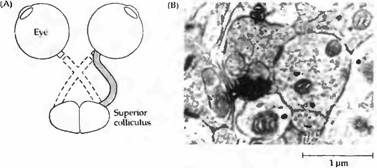
Рис. 3. Соединение сетчатки и верхнего бугра с помощью имплантанта периферического нерва у взрослой крысы. (А) Зрительные нервы были пересечены, один из них был замещен отрезком малоберцового нерва длиной 3--4 см (серый цвет). Регенерация тестировалась с помощью меток, антероградно перемещаемых после инъекций в глаз или регистрацией ответов нейронов верхнего бугра на освещение сетчатки. (В) Электронно-микроскопическая аут радиограмма регенерированной терминали аксона ганглиоэной клетки сетчатки в верхнем бугорке. [ Н]-меченые аминокислоты были инъецированы в глаз за2 дня до получения срезов мозга; серебряные зерна, показывающие меченые белки, транспортированные из глаза, служили для распознавания терминален аксона ганглиозных клеток. Регенерированные терминали были похожи на таковые у контрольных животных; они были заполнены круглыми синаптическими везикулами и формировали асимметричные синапсы.
Регенерация в незрелой ЦНС млекопитающих
По сравнению с нервной системой взрослых, незрелая ЦНС млекопитающих обеспечивает более благоприятные условия для регенерации. Например, если спинной мозг новорожденного опоссума передавлен или перерезан, аксоны прорастают через участок повреждения. Проводимость через поврежденный участок восстанавливается через несколько дней, даже если спинной мозг извлечен и помещен в культуральную среду. Сходные результаты получены на эмбриональном спинном мозге крысы и мыши в условиях культуры. У новорожденного опоссума даже после полного пересечения спинного мозга после заживления наблюдается полная и точная регенерация и отличное восстановление функций. Например, аксоны чувствительных нейронов восстанавливают прямые синаптические связи с двигательными нейронами и животное может координирование ходить, плавать и прыгать.
Спинной мозг 9-дневного опоссума регенерирует хорошо, а 12-дневного — уже нет. Поразительным свойством спинного мозга 9--дневного опоссума является отсутствие миелина и малое количество глиальных клеток. Действительно, конец критического периода, в течение которого может осуществляться успешная регенерация, совпадает с появлением олигодендроцитов, миелиновых оболочек и ингибирующих нейрональный рост протеинов N1-35 и N1-250. Сходно с этим, у эмбрионов цыплят нейроны ствола мозга будут успешно регенерировать свои спинальные аксоны, если спинной мозг был рассечен до начала миелинизации. Позже регенерация становится невозможной, за исключением тех случаев, когда миелинизания волокон по какой-то причине запаздывает или если она нарушена. Эти экспериментальные модели дают возможность изучения молекулярных механизмов, облегчающих и ингибирующих регенерацию в центральной нервной системе
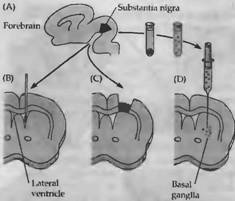
Рис. 4. Процедура трансплантации ткани эмбриона в мозг взрослой крысы. Ткань, богатая клетками, содержащими дофамин, бралась из черной субстанции (А) и инъецировалась в боковой желудочек (В) или имплантировалась в пространство коры, покрывающей базальные ганглии (С). Как альтернативный подход, суспензия диссоциированных клеток черной субстанции могла быть инъецирована непосредственно в базальные ганглии (D). Эти эмбриональные клетки выживали, росли и секретировали трансмиттер.
Нейрональные трансплантаты
Наиболее распространенными заболеваниями ЦНС человека являются болезни, обусловленные спонтанной дегенерацией нейронов, такие как болезни Паркинсона, Альцгеймера и Хантингтона Большинство нервных клеток у взрослых являются постмитотическими; в настоящее время неизвестны физиологические механизмы восстановления утерянных нейронов. Одним из подходов для замещения погибших нервных клеток, предпринятых Бьерклундом и коллегами, являлась трансплантация нервных клеток эмбриона в мозг взрослого организма. В отличие от нейронов взрослого организма, погибающих при трансплантации, нервные клетки эмбрионов или новорожденных животных после перемещения в серое вещество ЦНС взрослого выживали и развивались (рис. 4.). Имплантированные клетки дифференцировались, проращивали аксоны и освобождали нейротрансмиттеры из нервных терминалей.
Ярким примером такого рода являются эксперименты, в которых после разрушения дофамин-содержащих нейронов черной субстанции эмбриональные нейроны были трансплантированы в базальные ганглки крысы. Гибель нейронов черной субстанции воспроизводит дефицит, напоминающий болезнь Паркинсона у людей. У нормальных животных дофаминергические нейроны черной субстанции, располагающиеся в среднем мозге, иннервируют клетки базальных ганглиев (часть мозга, вовлеченная в программирование движений, аппендикс). При одностороннем повреждении этого дофаминового тракта результатом было нарушение движения; в ответ на стрессовый сигнал животное поворачивалось в сторону повреждения. Эта асимметрия движений исчезала после трансплантации в базальные ганглии на стороне повреждения дофаминсодержаших эмбриональных нейронов черной субстанции. Улътраструктурные исследования показали, что трансплантированные нейроны удлиняют аксоны, проникая в окружающие участки мозга и формируя синапсы с нейронами реципиента.
Степень функциональной компенсации в результате операции трансплантации нейронов зависит от успешности восстановления синаптических контактов. Удивительно, что полноценная интеграция нейронов в сложную нейрональную сеть мозга происходит нормально у взрослого. Так же хорошо у взрослых происходит восстановление после имплантации эмбриональной ткани в поврежденную кору, гиппокамп и полосатое тело. Трансплантированная в мозг новорожденной крысы эмбриональная сетчатка способна к формированию специфических функциональных синапсов, восстанавливая таким образом соответствующие зрительные рефлексы. Трансплантация эмбриональной энторинальной коры взрослым крысам с повреждениями энторинальной коры головного мозга может реиннервировать деафферентированные зоны гиппокампа, формировать синаптические контакты и частично восстанавливать дефицит пространственной памяти.
