Страница
2
Нейротрофины также могут играть определенную роль и в ЦНС взрослых животных. Физиологическая активность вызывает экспрессию определенных нейротрофинов в разных областях ЦНС и в ответ на различные стимулы. В свою очередь, нейротрофины, как было показано, способны влиять на физиологическую активность, облегчая синаптическую передачу и увеличивая или уменьшая возбудимость нейронов посредством регуляции экспрессии ионных каналов.
Рецепторы к нейротрофинам
Нейротрофины взаимодействуют с двумя типами рецепторов на поверхности нейронов--мишеней (см. рис. 3). Все нейротрофины связываются с относительно одинаковой и низкой активностью (Кd = 10--9 М) с мембранным рецептором, который был первоначально описан как низкоаффинный быстрый рецептор ФРН, или p75NGFR; более правильно называть этот рецептор низкоаффинным рецептором к нейротрофинам, или p75LNTR этот рецептор экспрессируется как в нейрональных, так и в ненейрональных клетках. Также существуют высокоаффинные (Кd = 10-11 М) рецепторы к нейротрофинам. Результаты биологических проб показывают, что эффекты нейротрофинов на выживание клеток и на рост отростков нервов обусловливаются высокоаффинными рецепторами.
Хотя высокоаффинные рецепторы к ФРН обычно расположены только на нейронах, они были первоначально обнаружены в клетках карциномы толстой кишки человека, как часть продукта синтеза онкогена trk (онкогенами называют гены, которые управляют трансформацией клеток). Аналог онкогена trk, находящийся в нормальных клетках, кодирует белок с массой около 140 кДа, называемый pl40prototrk или просто Trk. Структура белка Trk, предсказанная на основе его аминокислотной последовательности, состоит из внеклеточного домена, содержащего сайтдомен, кодирующий тирозинкиназу (рис. 3). Существуют по крайней мере три члена семейства про-онкогенов trk, каждый из которых является высокоаффинным рецептором для одного или нескольких нейротрофинов: TrkA — рецептор к ФРН и NT-6; TrkB, по видимому, является рецептором к МНФ и NT-4/5, a TrkC является рецептором к NT-3.
Связывание нейротрофинов с высокоактивными рецепторами приводит в первую очередь к увеличению фосфорилирования тирозина рецепторами. Это происходит вследствие аутофосфорилирования; вызванное лигандом образование рецепторного димера способствует приближению друг к другу внутриклеточных доменов тирозинкиназы каждого рецептора таким образом, что они фосфорилируют друг друга. Фосфорилирование рецептора Trk активирует четыре внутриклеточных сигнальных пути: фосфорилирование тирозина белка, названного SNT (suc-associated neurotrophic factor-induced tyrosine-phosphorylated target, связанная с suc и тирозин-фосфорилируемая в ответ на нейтрофические факторы мишень), фосфолипазу С, фосфоинозитол-3-киназу и каскад Ras-MAP киназы (рис. 4) .
Функция низкоаффинного рецептора, который не имеет внутриклеточных доменов, неизвестна. В некоторых клетках он может взаимодействовать с высокоаффинным рецептором во время связывания нейротрофинов. В других клетках, особенно в тех, в которых нет высокоаффинных рецепторов, он может управлять гибелью клеток или обеспечивать механизм ограниченной диффузии для установления высокой локальной концентрации нейтротрофинов, что необходимо для регенерации периферического нерва.
Конкурентные взаимодействия во время развития
После того как аксон достигает своих мишеней и образует синаптические связи, два процесса управляют паттерном иннервации. Одним является период гибели клеток, когда большое количество нейронов, которые установили синаптические связи, погибает. Вторым является уменьшение количества аксонов и синапсов, что сопровождается реорганизацией оставшихся связей, формирующих взрослый паттерн иннервации. Каждый из этих процессов регулируется конкуренцией за ограниченное количество факторов роста.
Гибель нейронов
Удивительной особенностью развития нервной системы является то, что многим ее нейронам суждено погибнуть во время развития. У беспозвоночных интенсивная гибель нейронов сопровождается стремительными изменениями, происходящими во время метаморфоза, и регулируется гормонами. Однако в развивающейся ЦНС как позвоночных, так и беспозвоночных гибель клеток происходит также и в отсутствие значительных морфологических изменений.
Эксперименты, выполненные Гамбургером и Леви-Монтальчини, впервые выявили запрограммированную гибель нейронов эмбрионов позвоночных, а также показали, что степень гибели клеток может зависеть от размеров ткани-мишени. Они показали, например, что в развивающейся конечности в то время, когда формируются первые синаптические связи с миофибриллами, от 40 до 70 % мотонейронов, которые послали аксоны в эту конечность, погибают. Имплантация дополнительной конечности уменьшает долю погибающих мотонейронов, а удаление одного из зачатков конечностей приводит к увеличению числа гибнущих клеток, что дает основания для предположения, что мотонейроны конкурируют за некие трофические вещества, выделяемые тканью-мишенью.
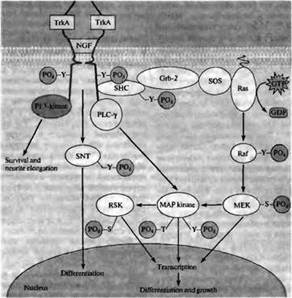
Рис. 3. Связывание димера фактора роста нервов с двумя TrkA рецепторами приводит к тому, что домен внутриклеточного белка тирозинкиназы каждого из TrkA рецепторов фосфорилирует остатки тирозина другого TrkA рецептора. Это запускает четыре внутриклеточных сигнальных каскада, которые приводят к росту и дифференцировке. Активация фосфоинозитол-3-киназы (PI 3-kinase) способствует удлинению отростков и их выживанию. Фосфорилирование тирозина SNT приводит к дифференцировке. Активация фосфолипазы C-γ (PLC-τ) стимулирует MAP киназы, которые индуцируют экспрессию генов, дифференцировку и рост как непосредственно, так и через фосфорилирование RSK. MAP киназа также активируется через сигнальный каскад, который включает связывание белков SHC, Grb-2, SOS и Ras, а также киназ Raf и МЕК. — S— Р04 — фосфорилирование серина; — Т — Р04 — фосфорилирование треонина; — Y — Р04 — фосфорилирование тирозина.
В самом деле, большое разнообразие нейротрофических белков, в основном вырабатываемых в мышце, как было обнаружено, могут управлять развитием мотонейронов: МНФ, NT-3 и NT-4/5, ИФР (инсулиноподобный фактор роста, IGF, insulin-like growth factor), CNTF (ciliary neurotrophic factor, нейротрофический фактор ресничек), GDNF (glial-derived neurotrophic factor, глиальный нейротрофический фактор), CDF (cholinergic differentiation factor, фактор холинергической дифференцировки, также называемый LIF, leukemia inhibitory factor, фактор подавляющий лейкемию) и ИФР-I (инсулиноподобный фактор роста 1). При введении их эмбриону эти белки предупреждают гибель мотонейронов, которые без этих факторов неминуемо погибли бы. Однако существует и несколько доказательств, включая анализ мутантных мышей, у которых отсутствует один или несколько подобных белков или их рецепторов, которые показывают, что ни один из этих факторов не является необходимым для выживания мотонейрона во время развития. Наилучшим кандидатом для фактора, регулирующего выживание мотонейрона, является еще пока неидентифицированный лиганд рецептора CNTF .
