Спецификация нервной ткани
Общая схема региональной дифференцировки
Рострокаудальный и дорзовентральный градиенты факторов транскрипции определяют локальную идентификацию клеток в пределах ЦНС. Эти же факторы способны приводить к развитию довольно различных свойств в зависимости от того, в каком месте эмбриона они экспрессируются. Например, белок Sonic hedgehog определяет вентральный фенотип вдоль рострокаудальной оси, приводя к образованию мотонейронов в спинном мозге, серотонинергических нейронов в передней части заднего мозга, дофаминергических нейронов в задней части заднего мозга, глазодвигательных нейронов в передней области среднего мозга. Подобным же образом другие факторы транскрипции (ВМР-4 и ВМР-7) приводят к образованию дорзального фенотипа30). Общим правилом является то, что возможные пути развития плюрипотентной клетки-предшественницы в определенной области развивающейся нервной системы в первую очередь ограничиваются ее положением относительно переднезадней оси, например, путем экспрессии Нох генов (рис. 23.9)31). Возможные клеточные фенотипы в дальнейшем еще более ограничиваются с учетом дорзовентрального положения по средней линии при помощи таких посредников, как Sonic hedgedog.
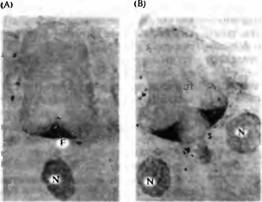
Рис. 3. Индуцированное хордой образование базальной пластинки и двигательных нейронов во время развития спинного мозга. (А и В) Специфическая окраска при помощи антител к клеткам базальной пластинки (F). (А) Нормальный эмбрион цыпленка. (В) Добавление клеток второй хорды (N) вызывает образование второй базальной пластинки. (С и D) Специфическая окраска при помощи антител к клеткам базальной пластинки, двигательным нейронам и афферентам спинального ганглия. (С) Нормальный эмбрион. (D) При удалении хорды клетки базальной пластинки и двигательной пластинки отсутствуют, а клетки спинального ганглия (D) занимают необычное вентральное положение. Аксоны сенсорных интернейронов, которые обычно идут в составе вентральной части спинного мозга, сейчас формируют пучки волокон, которые покидают спинной мозг (стрелка).
Происхождение нейронов и клеток глии
У позвоночных индукционные взаимодействия между клетками играют важную роль в определении их дальнейшей судьбы. У более простых организмов судьба клетки может быть определена автономно на основании ее происхождения.
Происхождение клеток и индукционные взаимодействия в простых нервных системах
Происхождение клеток наиболее хорошо исследовано на примере простых беспозвоночных, таких как пиявка, кузнечик, плодовая муха и маленькая нематода Caenorhabditis elegans. В этих препаратах возможно проследить развитие каждой клетки и исследовать формирование таких характеристик, как свойства мембраны, трансмиттеры, рост аксонов и их ветвление. У С. elegans, которая содержит всего около 300 нейронов, эмбрион настолько маленький и прозрачный, что можно идентифицировать каждый нейрон и проследить его работу при помощи микроскопа. Альтернативным подходом может быть маркирование отдельных клеток и определение того, какие типы клеток из них получаются. Такого рода анализ, впервые предложенный Вайсблатом, Стентом и их коллегами для эмбрионов пиявки, включает в себя введение внутриклеточных маркеров, таких как флуоресцентный декстран или фермент пероксидаза хрена (HPR), в отдельные клетки и таким образом исследование дальнейшего потомства либо на живом эмбрионе, либо после окраски эмбриона, когда можно увидеть клетки, в которых находится фермент. Можно провести сравнительные эксперименты, вводя комплементарные цепи ДНК, кодирующие гены флуоресцентного белка, или создавая трансгенных животных, которые экспрессируют этот протеин.

Рис. 4. Система координат пространственной информации в заднем мозге позвоночных, устанавливаемая в два этапа. (А) Сначала определяется рострокаудальная позиция, например по экспрессии гена Hox. (В) После этого дорзовентральная позиция определяется градиентами сигналов средней линии, такими как Sonic Hedgehog и BMP 4/7. (С) Результирующая двумерная система координат пространственной информации ограничивает возможный репертуар клеточной дифференцировки плюрипотентных клеток-предшественников.
Эксперименты подобного рода показывают, что у простых беспозвоночных вполне возможно воспроизвести определенную последовательность в делении и дифференцировке клеток. Таким образом, используя луч лазера можно вызывать гибель отдельных идентифицированных клеток с целью проследить, каким образом это повлияет на судьбу оставшихся клеток. В большинстве случаев выжившие клетки игнорируют потерю своего соседа, направление их развития определено автономно, на основании того, к какой клеточной линии они принадлежат. У подобных клеток экспрессия генов определяется факторами, которые изначально находятся в их цитоплазме или ядре и представляют собой независимые внутриклеточные сигналы. В других случаях, однако, потеря соседа может повлиять на судьбу выживших клеток. Таким образом, даже у животных, у которых имеются жестко определенные паттерны деления клеток, их дальнейшее развитие может изменяться в зависимости от индукционных взаимодействий.
Индукционные взаимодействия при развитии глаз дрозофилы
Стереотипно происходящее развитие сложного глаза дрозофилы представляет собой еще одну систему, в которой возможно прямое наблюдение для идентификации отдельных клеток и прослеживания их дальнейшего развития. Кроме того, генетика дрозофилы дает очень большие возможности для оценки роли происхождения клеток и индукционных взаимодействий между ними в дифференцировке нервной ткани. Возможно выделение мутантов, у которых нет определенного клеточного типа или у которых паттерн дифференцировки лишь незначительно нарушен, что позволяет определить их влияние на судьбу остальных клеток.
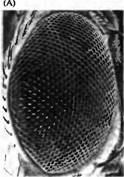
Рис. 4. Индукционные взаимодействия, регулирующие развитие фоторецепторных клеток у дрозофилы. (А) Сканограмма сложного глаза дрозофилы. Каждая фасетка представляет собой один омматидий. (В) Нормальное развитие дифференцировки восьми фоторецепторов в каждом омматидий. Seven/ess (sev-- ) и bride of seven (boss ) мутации нарушают дифференцировку R7. (С) Сигнальные каскады, регулирующие дифференцировку R7. Продукт boss гена, интегральный мембранный белок, экслрессируемый в R8 (Boss), активирует продукт гена sev, рецептора тирозинкиназы (SevRTK). Sev киназа запускает внутриклеточный сигнальный каскад, активирующий MAP киназу, которая имеет несколько мишеней. MAP киназа фосфорилирует протеин Van (который бы иначе блокировал дифференцировку), приводя к его распаду. MAP киназа также вызывает экспрессию белка Phyl который вместе со вторым протеином, Sina, приводит к распаду фактора транскрипции Ttk88 Ttk88 предотвращает нервную дифференцировку. MAP киназа также активирует Pntp2 и АР-1, два фактора транскрипции, которые способствуют нейрональной дифференцировке.
