рДНК-биотехнология. Способы биотрансформации клеток
1) ДНК-полимеразной, использующей в качестве матрицы как РНК, так и ДНК;
2) активностью РНКазы Н, гидролизующей РНК в составе гибрида РНК—ДНК, но не одно- или двухцепочечную РНК;
3) ДНК-эндонуклеазной активностью.
Первые две активности необходимы для синтеза вирусной ДНК, а эндонуклеаза, по-видимому, важна для интеграции вирусной ДНК в геном клетки-хозяина. Очищенная обратная транскриптаза синтезирует ДНК как на РНК-, так и на ДНК-матрицах. Чтобы начать синтез, ревертазе, как и другим полимеразам, необходим короткий двухцепочечный участок (праймер). Праймером может служить одноцепочечный сегмент как РНК, так и ДНК, которые в процессе реакции оказываются ковалентно связанными с новосинтезированной цепью ДНК.
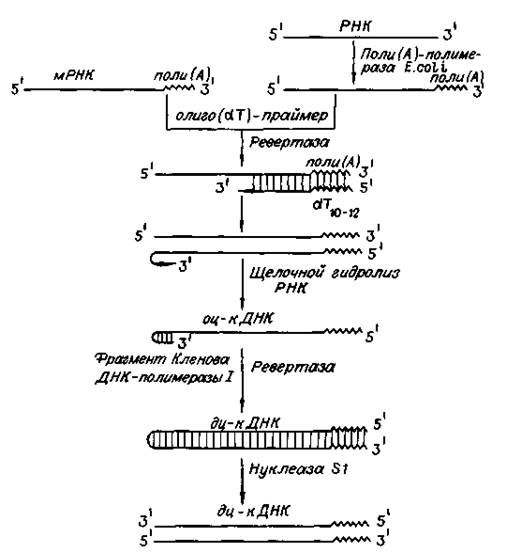
Рис. 3. Схема синтеза двухцепочечных ДНК-копий молекул РНК
Обратную транскриптазу преимущественно используют для транскрипции матричной РНК в комплементарную ДНК (кДНК). Реакцию обратной транскрипции проводят в специально подобранных условиях с использованием сильных ингибиторов РНКазной активности. При этом удается получать полноразмерные ДНК-копии целевых молекул РНК. В качестве праймера при обратной транскрипции поли (А)-содержащих мРНК используют олигo (dT), а для молекул РНК, не имеющих З'-поли (А) концов, — химически синтезированные олигонуклеотиды, комплементарные З'-концу изучаемой РНК. После синтеза на мРНК комплементарной цепи ДНК и разрушения РНК (обычно применяют обработку щелочью) осуществляют синтез второй цепи ДНК. При этом используют способность ревертазы образовывать на 3'-концах одноцепочечных кДНК самокомплементарные шпильки, которые могут выполнять функции праймера.
Матрицей служит первая цепь кДНК. Данная реакция может катализироваться как ревертазой, так и ДНК-полимеразой I E. coli. Показано, что сочетание этих двух ферментов позволяет повысить выход полноценных двухцепочечных молекул кДНК. По окончании синтеза первая и вторая цепи кДНК остаются ковалентно связанными петлей шпильки, служившей праймером при синтезе второй цепи. Эту петлю расщепляют эндонуклеазой S1, специфически разрушающей одноцепочечные участки нуклеиновых кислот. Образующиеся при этом концы не всегда оказываются тупыми, и для повышения эффективности последующего клонирования их репарируют до тупых с помощью фрагмента Кленова ДНК-полимеразы I E. coli. Полученную двухцепочечную кДНК можно затем встраивать в клонирующие векторы, размножать в составе гибридных молекул ДНК и использовать для дальнейших исследований.
1.3 Лигазы
В 1961 г. Мезельсон и Вейгл на примере фага l показали, что рекомбинация включает разрыв и последующее воссоединение молекул ДНК. Это положило начало поискам фермента, участвующего в сшивании фрагментов ДНК. В 1967 году такой фермент был найден и получил название ДНК-лигаза. Он катализирует синтез фосфодиэфирной связи в 2-х цепочечной молекуле нуклеиновой кислоты.
Иными словами, ДНК-лигазы сшивают рядом расположенные нуклеотиды, образуя связь между остатками сахаров. ДНК-лигазы абсолютно необходимы в процессах репарации ДНК, в процессах репликации - при удвоении цепи ДНК.
Существует 2 типа ДНК-лигаз, отличающихся по потребностям в кофакторах и способу действия. ДНК-лигаза E. coli в качестве кофактора использует дифосфопиридиннуклеотид, а лигаза фага Т4 - АТФ в присутствии Mg2+. Лигаза фага Т4 более универсальна, так как помимо лигирования липких концов способна катализировать реакцию воссоединения двухцепочечных фрагментов ДНК с тупыми концами. Она используется чаще.
2 Введение нового гена в клетку
Ввести рекомбинантный ген в клетку можно 2 способами: используя вектора или путем прямого введения.
Требования к векторной ДНК, ее состав
Вектор - молекула ДНК или РНК, состоящая из двух компонентов: векторной части (носителя) и клонируемого чужеродного гена. Задача вектора – донести выбранную ДНК в клетку-рецепиент, встроить ее в геном, позволить идентификацию трансформированных клеток, обеспечить стабильную экспрессию введенного гена.
Таким образом, вектор должен быть небольшим, способным поддерживаться в клетке-хозяине (реплицироваться), многократно копироваться (ампфлицироваться), экспрессировать соответствующий ген (содержать соответствующие регуляторные последовательности), должен иметь маркерный ген, позволяющий различать гибридные клетки для эффективной селекции их; должен быть способен передаваться в клетку соответствующего организма.
Регуляторные последовательности, отвечающие за стабильную экспрессию гена, будут рассмотрены позднее.
Можно выделить 2 группы маркерных генов, позволяющие отличить трансформированные клетки:
1. Селективные гены, отвечающие за устойчивость к антибиотикам (канамицину, тетрациклину, неомицину и др.), гербицидам (у растений). Это могут быть гены ауксотрофности по какому-либо субстрату и т.д. Основной принцип работы такого маркера – способность трансформированных клеток расти на селективной питательной среде, с добавкой определенных веществ, ингибирующих рост и деление нетрансформированных, нормальных клеток.
2. Репортерные гены, кодирующие нейтральные для клеток белки, наличие которых в тканях может быть легко тестировано.
Чаще всего в качестве репортерных используются гены β-глюкуронидазы (GUS), зеленого флюоресцентного белка (GFP), люциферазы (LUC), хлорамфениколацетилтрансферазы (CAT). К настоящему времени из этого арсенала наиболее часто используют гены GUS и GFP и, в меньшей степени, LUC и CAT. Используемый в настоящее время как репортерный ген GUS является модифицированным геном из Escherichia coli, кодирующим β-глюкуронидазу с молекулярной массой 68 кД. GUS активен в широком диапазоне условий среды с оптимумом при рН 5-8 и 37°С. Он может гидролизовать обширный спектр природных и синтетических глюкуронидов, что позволяет подбирать соответствующие субстраты для спектрофотометрического или флюориметрического определения активности фермента, а также для гистохимического окрашивания тканей in situ (например, в синий цвет). Фермент достаточно стабилен: он устойчив к нагреванию (время полужизни при 55°С составляет около 2 ч) и к действию детергентов. В процессе замораживания-оттаивания потери активности GUS не происходит. В составе химерных белков, созданных генно-инженерными методами, GUS обычно сохраняет свою функциональную активность. В живых клетках белок GUS также весьма стабилен и активен от нескольких часов до нескольких суток.
GFP (green fluorescent protein - зеленый флюоресцентный белок, или белок зеленой флюоресценции) был обнаружен Shimomura с соавт. в 1962 г. у люминесцирующей медузы Aequorea victoria. Ген GFP был клонирован в 1992 г. Prasher и соавт., и уже через несколько лет началось активное использование этого гена как репортерного в работах с самыми разными про- и эукариотическими организмами. В настоящее время ген GFP применяется в сотнях работ во всем мире, и число их стремительно нарастает. Столь быстрый рост вызван особыми свойствами белка GFP, а именно его способностью флюоресцировать в видимой (зеленой) области спектра при облучении длинноволновым УФ. Эта флюоресценция обусловлена непосредственно белком, для ее проявления не требуется субстратов или кофакторов. Благодаря этому свойству ген GFP является очень перспективным репортерным геном, позволяющим проводить разнообразные прижизненные (недеструктивные) исследования с трансгенными организмами.
