Страница
2
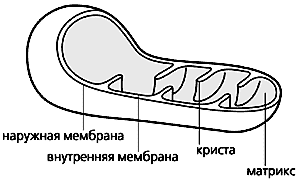
Схема строения митохондрии.
Митохондрии, эти клеточные органеллы с двойной мембраной, обладают, как известно, собственным геномом и способны автономно размножаться. Внутренняя мембрана образует глубокие складки - кристы. В ограниченном ею пространстве, митохондриальном матриксе, находятся ферменты энергетического метаболизма. Митохондрии обеспечивают всю клеточную жизнь, поскольку служат энергетическими станциями: здесь энергия питательных субстратов запасается в доступной для клетки форме, в виде аденозинтрифосфата (АТФ). Он синтезируется за счет энергии, высвобождающейся при переносе электронов с атомов водорода, образовавшихся при переработке субстратов, на конечный акцептор - кислород. Белки, переносящие электроны, встроены во внутреннюю мембрану митохондрий и образуют электронтранспортную цепь (ЭТЦ). Ее конечный элемент - цитохром с-оксидаза - и передает электроны от цитохрома с на кислород (это клеточное дыхание).

Схема окислительного фосфорилирования (слева), в ходе которого синтезируется АТФ. Высокоэнергетические электроны проходят по переносящей их цепи, и часть высвобождаемой при этом энергии используется для откачивания протонов из матрикса. На внутренней мембране возникает электрохимический протонный градиент, благодаря чему Н+ снова возвращаются в матрикс через АТФ-синтетазу. Этот фермент использует энергию протонного тока для синтеза АТФ из АДФ и неорганического фосфата (P). На рисунке приведены также схема строения АТФ-синтетазы (в середине) и модель действия этого фермента.
Протоны, оставшиеся после отрыва электронов от атомов водорода, за счет энергии электронного транспорта выталкиваются из матрикса в межмембранное пространство. Возникающая при этом разность концентраций (градиент) ионов Н+ создает мембранный потенциал митохондрий (Dym), энергия которого и используется для фосфорилирования аденозиндифосфата (АДФ).
Фермент АТФ-синтетаза, катализирующий образование АТФ из АДФ и неорганического фосфата, представляет собой встроенное во внутреннюю мембрану грибовидное тельце с каналом в центре. Когда ион Н+ прорывается по этому каналу в матрикс, энергия протонного тока идет на синтез АТФ. Других путей возвращения в матрикс у протона нет, поскольку в нормальном состоянии внутренняя мембрана непроницаема для ионов. Процесс синтеза АТФ за счет энергии переноса электронов называется окислительным фосфорилированием.
В матриксе протоны соединяются с кислородом, восстановленным в ходе работы электронтранспортной цепи, и образуется вода. Но если он восстанавливается не полностью, появляются активные формы кислорода (АФК): супероксидный радикал (О2·–), перекись водорода (Н2О2) и гидроксильный радикал (ОН·). В митохондриях образование АФК, этого побочного продукта, усиливается при повышении скорости потока электронов, увеличении концентрации кислорода и разобщении дыхания и окислительного фосфорилирования веществами, которые вызывают проницаемость внутренней мембраны.
Органеллы, обеспечивающие жизнедеятельность клетки, обеспечивают и ее смерть. При сильном стрессовом воздействии (переохлаждении; нагревании; стимуляции образования АФК другими структурами клетки, помимо митохондрий; перекисном окислении липидов плазматической мембраны - чаще всего при облучении) в цитоплазме резко повышается концентрация ионов кальция. Если кальциевые депо клетки не справляются с его утилизацией, открывается так называемая митохондриальная пора диаметром 2.6-2.9 нм. Она представляет собой канал, проходящий через обе митохондриальные мембраны и состоящий из трех белков: транслокатора адениновых нуклеотидов, потенциалзависимого анионного канала (порина) и бензодиазепинового рецептора. Когда этот комплекс связывается с Са2+, через мембранную пору могут проходить вещества с небольшой молекулярной массой. Это приводит к падению мембранного потенциала и набуханию матрикса, целостность внешней мембраны неизбежно нарушается, и из межмембранного пространства в цитоплазму выходят белки апоптоза. Их несколько: фактор, индуцирующий апоптоз (APOptosis-inducing factor - AIF), вторичный митохондриальный активатор каспаз (second mitochondria-derived activator of caspases - Smac) и некоторые прокаспазы. Индуцирующий фактор направляется прямо в ядро, где вызывает деградацию ДНК.
Наряду со специфически апоптозными белками, из митохондрии через открытую пору выходит цитохром с, который в норме служит конечным звеном электронтранспортной цепи. В цитоплазме этот белок связывается с белком Apaf-1 (APOptotic protease activating factor-1 - активирующий протеазу фактор-1) и формирует апоптосомный комплекс. Он с помощью Smac и еще одного фактора (Omi/HtrA2) активирует прокаспазу-9, та, став каспазой-9, превращает два других профермента в каспазы-3 и -7; а они уже расщепляют структурные белки, приводя к появлению биохимических и морфологических признаков апоптоза. В числе первых можно назвать, в частности, переход фосфатидилсерина в наружный мембранный слой и фрагментацию ДНК. Из вторых признаков наиболее характерны “отшелушивание” клетки от матрикса, сморщивание мембраны, сжатие ядра и формирование пузырьков с клеточным содержимым - апоптозных телец.
Цитохром с электростатически и гидрофобно связан с внутренней мембраной митохондрий через фосфолипиды, преимущественно через кардиолипин. Электростатически взаимодействуют между собой положительно заряженные остатки аминокислоты лизина в цитохроме и отрицательно заряженные фосфатные группы в кардиолипине. За счет гидрофобного взаимодействия между углеродной цепью этого фосфолипида и гидрофобными участками молекулы цитохрома еще более укрепляется связь фермента с митохондриальной мембраной, что обеспечивает даже его частичное погружение в ее слой.
Следовательно, для выхода цитохрома с в цитоплазму одного лишь нарушения целостности митохондриальной мембраны недостаточно. Электростатически связанный цитохром с может оторваться от кардиолипина, если изменяется ионная сила, плотность поверхностного заряда или рН, а связанный гидрофобно - за счет окислительной модификации митохондриальных липидов. Последнюю реакцию как раз и вызывают активные формы кислорода, которые неизбежно образуются при любых сильных воздействиях (стрессах), а открывание поры усиливает этот процесс.
Однако цитохром с не всегда нужен для запрограммированной смерти. Апоптоз в сердечной ткани, например, вообще протекает без этого фермента, он так и не выходит из межмембранного пространства.
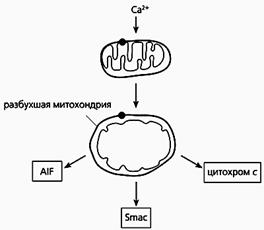
Фрагмент схемы апоптоза, протекающего по митохондриальному пути.
Под действием избытка ионов кальция митохондрия разбухает, через пору из нее выходит цитохром с и два белка - AIF и Smac. Первый белок индуцирует апоптоз, а второй активирует некоторые прокаспазы.
Цитохром с может высвобождаться в ответ на повышение концентрации ионов Са2+, которое вызывает открывание поры. Но выход фермента “на свободу” может и не зависеть от этих ионов, тогда процесс контролируют белки семейства Bcl-2 (B-cell leukaemia-2 - лейкемия В-клеток-2). Именно они регулируют апоптоз на уровне митохондрий. Одни из белков этого большого семейства (Bcl-2, а также Bcl-xL, Bcl-w, Mcl-1, Al и Boo) предотвращают апоптоз; другие (Вах, Bad, Bok, Bcl-xS, Bak, Bid, Bik, Bim, Krk, и Mtd) способствуют самоубийству. Вот один пример работы белков этого семейства регуляторов. Цитозольный белок Bid расщепляется каспазой-8, активируемой через “рецепторы смерти”, и лизосомными протеазами катепсинами, чей выход из лизосом стимулирует эта же каспаза. Образовавшийся активный белок - усеченный Bid (truncated Bid - t-Bid) - изменяет конформацию другого проапоптозного белка, Вах, после чего тот встраивается во внешнюю мембрану митохондрий, где формирует комплекс с порином. Вместе они выстилают канал, по которому из межмембранного пространства выходят цитохром с и проапоптозные белки. Но если в дело вмешивается Bcl-2, действующий как антиоксидант, выход цитохрома блокируется.
