Страница
3
Чтобы вклиниться в это явление «взаимной страховки», т. е. чтобы блокировать восстановление первой разорванной связи до того момецта, когда разорвется и вторая связь, потребуется значительное увеличение концентрации контрионов соли в элюенте. Если же молекуле белка удастся закрепиться в трех точках, то снять ее окажется очень трудно или даже невозможно (произойдет необратимая сорбция белка на ионообменнике).
В силу сказанного, для успешного фракционирования смеси белков следует до внесения препарата на колонку уравновесить жидкую фазу обменника раствором соли такой концентрации, которая гарантировала бы образование не более, чем двухточечных связей для всех белков смеси с матрицей.
Выбор условий хроматографии (например, для фракционирования смеси белков)
Этот выбор, даже для случая, когда все подлежащие разделению белки известны и, более того, имеются в чистом виде, оказывается делом непростым, требующим немалого опыта, понимания физических процессов, лежащих в основе фракционирования и даже определенной интуиции. Очень рискованно (с точки зрения потери ценного препарата) пытаться слепо повторять условия хроматографии, описанные в научной литературе даже для точно такого же или очень похожего случая. Реальные характеристики ионообменника той же марки (они варьируют от партии к партии) или используемых реактивов могут оказаться иными. Равно как и особенности исходных препаратов. Приняв к сведению описанную процедуру, исследователь должен сам продумать и спланировать свой хроматографический эксперимент. Сюда войдут, как минимум:
1. Выбор ионообменника (его силы, размера гранул, пористости).
2. Выбор геометрии колонки (длина и диаметр).
3. Выбор рН буфера с позиций как наиболее выгодных условий фракционирования, так и сохранения биологической активности всех белков смеси, например ферментов.
4. Выбор концентраций соли (контрионов) в элюенте.
5. Выбор типа элюции: изократической (с неизменной концентрацией соли), ступенчатой или градиентной (и какой формы градиента!)
6. Выбор скорости элюции.
Все эти условия надо подбирать одновременно, с учетом их взаимосвязи с целью оптимизации результатов фракционирования. Было бы слишком громоздко излагать здесь способы выбора каждого из названных параметров хроматографического процесса. Для иллюстрации остановлюсь на пунктах 4 и 5 — выборе концентрации соли и способах манипуляции этой концентрацией.
Выше было показано, что продвижение хроматографических зон связывания белков по колонке обусловлено, в частности, их десорбцией в местах первоначального и всех последующих закреплений на матрице в гранулах. За счет десорбции восстанавливается динамическое равновесие концентраций молекул в неподвижной и подвижной фазах слоя гранул, нарушенное вытеканием элюента, окружавшего этот слой. Десорбция первоначально сор-бированных молекул белка определяется концентрацией соля в жидкости внутри гранул. Если она слишком мала, то десорбции практически не происходит. Наоборот — открытые ионогенние группы матрицы как бы «высасывают» из элюента и закрепляют на себе молекулы белка. Если же концентрация соли в элюенте (а значит и внутри гранул) слишком велика, то практически все молекулы белка десорбируются с матрицы в жидкую среду, их концентрации в неподвижной и подвижной фазах уравниваются, как при гель-фильтрации.
Имея это в виду проведем мысленно следующий предварительный опыт. Выбранный ионообменник, уравновешенный уже выбранным буфером разольем равными порциями в 10 пробирок. Гранулы обменника, естественно, сядут на дно. Затем серией «декантаций« (т. е. сливом надосадочной жидкости, заменой ее на тот же буфер, но с определенной концентрацией соли, встряхиванием, осаждением — и так несколько раз) добиваемся того, чтобы концентрация соли внутри гранул постепенно увеличивалась от первой пробирки к десятой в определенных пределах (их придется подобрать для каждого белка). Затем во все пробирки внесем одинаковое количество концентрированного водного раствора одного из белков, входящих в состав подлежащей фракционированию смеси. Встряхиваем пробирки, даем отстояться осадку и по ультрафиолетовому поглощению (или ферментативной активности) оцениваем концентрацию белка в каждом из десяти супернатантов.
Находим первую пробирку, в супернатанте которой наш белок только-только появляется. Тем самым определяем концентрацию соли, при которой динамическому равновесию соответствует минимальная десорбция белка с матрицы. В последующих пробирках по мере увеличения концентрации соли, белка будет становиться все больше — десорбция при установлении динамл-ческого равновесия будет все значительнее. Наконец, придем к такой ситуации, когда концентрация белка в супернатанте окажется максимальной и при дальнейшем увеличении концентрации соли возрастать уже не будет. Концентрация соли в первой из этих пробирок укажет момент полной десорбции белка с матрзицы. В процентах от этой концентрации оценим и степень десорбции в промежуточных точках нашего анализа и построим зависимость процента десорбции данного белка от концентрации соли в условиях динамического равновесия. То же самое проделаем для всех остальных белков будущей смеси и получим серию кривых такого типа, как показана на рис.
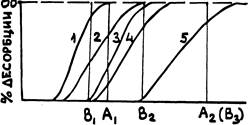
Рис.
Рассматривая эту серию кривых, можно заключить, что при изократической элюции буфером с неизменной солевой концентрацией, например, соответствующей точке Ар можно надеяться разделить белки 1—4. Белок 1 будет сразу же полностью десорбиpoвать и выйдет в первую очередь — с током элюента. За ним последуют в порядке возрастания прочности сорбции белки 2, 3 и 4. Зона связывания каждого последующего из них будет двигаться по колонке медленнее, чем зона предыдущего белка. Белок 5 в этих условиях вовсе не выйдет из зоны первоначального нанесения препарата на колонку. Его можно снять отдельно, увеличив концентрацию соли в элюенте до значения Ag. Это уже будет «двухступенчатая» элюция.
Если окажется, что при концентрации Аg белки 3 и 4 разделяются плохо, можно воспользоваться трехступенчатой элюцией, выбирая концентрации соли в точках Вр Bg и Bg. Тогда сначала выйдут хорошо разделившиеся белки 1 и 2, затем также неплохо разделенные белки 3 и 4 и, наконец, белок 5.
Литература:
1 Курашвили Л.В., Бобылева Л.Н. Определение триглицеридов во фракции липопротеидов высокой плотности /Лабораторное дело. - N 7. - 1991. - С.7576.
2 Курашвили Л.В., Владимирова А.А. Содержание триглицеридов в ЛПВП у больных ишемической болезнью сердца //Кардиология. - 7-8. - 1992. - С.35-38.
3 Курашвили Л.В., Волков А.С. Прогностическая значимость определения холестерина в фракции липопротеидов высокой плотности у доноров крови // Гематология и трансфузиология. - N 5. - 1993. - С.39-41.
