Страница
3
рН = -lg[Н+];
![]()
В практике принимается Kw = 10-14 (22 °С), отсюда [Н+] = 10-7 г-ион/л и рН = 7.
Соотношения между реакцией среды, концентрациями ионов и значением водородного показателя получаются следующие:
Нейтральная среда [Н3О+] = [ОН-] = 10-7 г-ион/л, рН = 7.
Кислотная среда [Н3О+] > [ОН-] > 10-7 г-ион/л, рН < 7.
Щелочная среда [Н3О+] < [ОН-] < 10-7 г-ион/л, рН > 7.
Это можно представить в виде схемы:

Гидролиз – процесс взаимодействия ионов соли с водой, приводящий к образованию слабого электролита.
Если соль рассматривать как продукт взаимодействия кислоты с основанием, то в зависимости от их силы все соли можно разделить на четыре типа по приведенной схеме.
Таблица: 1
|
Кислоты | |||
|
Сильные |
Слабые | ||
|
Основания |
Сильные |
I: NaCl, KNO3; pH=7 гидролиз не идет |
II: Na2CO3, K2S; рH > 7 |
|
Слабые |
III: ZnCl2, Al(NO3)3; pН < 7 |
IV: CH3COONH4, Al2S3 | |
Соли первого типа гидролизу не подвергаются, так как при их взаимодействии с водой слабые электролиты не могут быть получены. В системе Н2О ↔ Н+ + ОН- не нарушается равновесие. рН в растворах этих солей будет равно 7.
Рассмотрим гидролиз солей оставшихся трех типов. Соли, образованные многоосновными кислотами или многокислотными основаниями, гидролизируются ступенчато, переходя в первой фазе в кислотные или основные соли.
Гидролиз Na2CO3:
I ступень 2Na+ + CO32- + HOH <=> Na+ + HCO3- + Na+ + OH-
CO32- + HOH <=> HCO3- + OH-;
II ступень Na+ + HCO3- + HOH <=> H2CO3 + Na+ + OH-
HCO3- + HOH <=> H2CO3 + OH-.
При гидролизе Na2CO3 и других солей этого типа в растворе накапливаются ионы OH-, сообщающие ему щелочную реакцию с рН > 7. Более сильно выражена первая ступень гидролиза, чем вторая.
Гидролиз ZnCl2:
I ступень: Zn2+ + 2Cl- + HOH <=> ZnOH+ + Cl- + H+ + Cl-
Zn2+ + HOH <=> ZnOH+ + H+;
II ступень: ZnOH+ + HOH + Cl- <=> Zn(OH)2 + H+ + Cl-
ZnOH+ + HOH <=> Zn(OH)2 + H+.
При гидролизе ZnCl2 и других солей этого типа в растворе накапливаются ионы H+, сообщающие ему кислотную реакцию с рН < 7.
Гидролиз СН3СООNH4:
NH4 + CH3COO- + HOH <=> NH4OH + CH3COOH.
Соли этого типа подвергаются гидролизу относительно легко. Реакция и рН раствора определяется относительной силой образующихся оснований и кислот. В рассматриваемом случае константы электролитической диссоциации NH4OH и CH3COOH при 25 ºС соответственно равны 1,79·10-5 и 1,76·10-5, а поэтому реакция раствора практически нейтральна (рН = 7).
Процесс гидролиза солей количественно может быть охарактеризован с помощью двух величин: степени гидролиза h, константы гидролиза Кгидр.
Степенью гидролиза называется отношение количества молекул соли, подвергшихся гидролизу, к общему количеству молекул соли в растворе.
Очевидно, степень гидролиза h может изменяться в следующих пределах:
гидролиз полный
отсутствует гидролиз
0 £ h £ 1 в долях единицы
0 £ h £ 100 в %
Константа гидролиза определяет состояние химического равновесия в растворе гидролизированной соли.
Например, для равновесного состояния I ступени гидролиза Na2CO3 и ZnCl2 Кгидр выразится уравнениями:
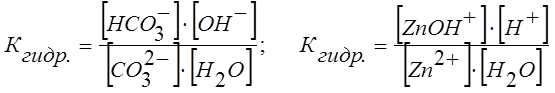 .
.
В общем случае Кгидр изменяется в следующих пределах:
гидролиз полный
отсутствует гидролиз
0 £ Кгидр £ ![]() .
.
На состояние равновесия гидролиза сильно влияют различные факторы: главным образом концентрация воды в растворе и температура системы.
Как видно из общего уравнения гидролиза
соль + вода <=> основание + кислота
и уравнения константы гидролиза
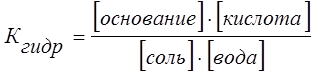
увеличение концентрации воды (или изменение концентрации соли) в растворе в силу постоянства Кгидр смещает равновесие слева направо. Поэтому разбавленные растворы солей гидролизируются полнее и быстрее, чем концентрированные, и степень гидролиза возрастает с разбавлением раствора.
Изменение температуры также резко влияет на состояние гидролитического равновесия: при повышении температуры степень гидролиза увеличивается, что объясняется резким возрастанием ионного произведения воды.
Список литературы
Глинка Н.Л. Общая химия. – М.: Химия, 1978. – С. 228-260.
Шиманович И.Е., Павлович М.Л., Тикавый В.Ф., Малашко П.М. Общая химия в формулах определениях, схемах. – Мн.: Унiверсiтэцкае, 1996. – С. 121-136.
Воробьев В.К., Елисеев С.Ю., Врублевский А.В. Практические и самостоятельные работы по химии. – Мн.: УП «Донарит», 2005. – С. 52-65.
* Диэлектрическая проницаемость e характеризует поляризацию диэлектриков под действием электрического поля Е.
