Белки- история исследования, химсостав, свойства, биологические функции
Таким образом, просматривая структуры пептидов Т и С, можно для любой пары Т-пептидов выявить, являются ли они соседями в исследуемом белке или разделены одним или несколькими другими Т-пептидами. Неоднозначность может появиться только в том случае, если перекрываемый каким-либо из С-петидов концевой фрагмент встречается у двух или нескольких Т-пептидов. Вероятность этого как правило невелика. Если это все же происходит, то применяют более сложные методы комбинаторики.
Глава 8. Химический синтез полипептидов и белков
Химический синтез полипептидов и белков имеет большое практическое и теоретическое значение. В практическом отношении важны белковые гормоны - инсулин и вазопрессин, в настоящее время получаемые синтетическим путем. Интересны и имеют практическое применение пептиды группы пептидов мозга: метионин-энкефалин (Tyr-Gly-Gly-Phe-Met) и лейцин-энкефалин (Tyr-Gly-Gly-Phe-Leu). Эти соединения оказывают на мозговые центры такое же действие, как и морфин. Таким образом они могут применяться в качестве анальгетика, однако они практически не вызывают привыкания.
Традиционные методы синтеза регулярных полимеров позволяют получить сополимеры, состоящие из двух (или более) сходных типов мономеров со статистическим распределением их по цепи, в том числе белков. В частности, возможно получение гомополимеров или статистических сополимеров, состоящих из аминокислотных остатков, связанных пептидными связями (полиаминокислот).
В качестве примера можно привести процесс получения полиаминокислот, основанный на конденсации N-карбоксиангидридов аминокислот, образуемых из соответствующих аминокислот обработкой фосгеном:
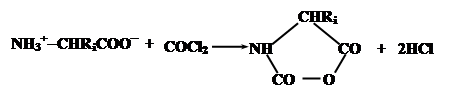 |
Эти соединения содержат электрофильную ангидридную группу, которая может атаковать алифатическую аминогруппу аминокислоты, используемой в качестве затравки, с выделением СО2 и одновременном освобождением новой аминогруппы из атакующей молекулы N-карбоксиангидрида, таким образом открывая возможность поликонденсации:
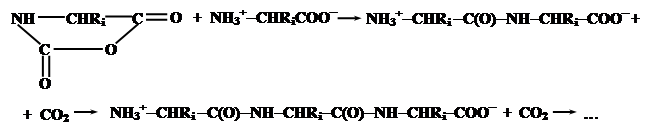
Нетрудно заметить, что каждая стадия поликонденсации (с учетом реакции образования N-карбоксиангидридов аминокислот) сопровождается превращением молекулы COCl2 в CO2 и 2HCl, что термодинамически выгодно и является источником свободной энергии для образования пептидной связи.
При синтезе нерегулярных полипептидов базируются также на активации карбоксильных групп. Большинство из них базируется на использовании N,N-дициклогексилкарбодиимида (ДЦК). Он способен в присутствии RCOO- и амина NH2R’ осуществить активацию карбоксильных групп:
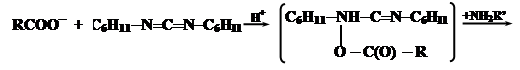 | |||
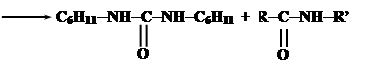 | |||
Промежуточнам соединением является O-ацил-N,N’-дициклогексилмочевину (ДЦМ):
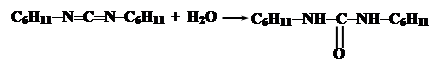
Обычно ДЦК в пептидном синтезе используется не непосредственно, а для синтеза стабильных реакционноспособных производных аминокислот, ангидридов или активированных эфиров путем реакции с соответствующими гидроксисоединениями:
 |
Вследствие нуклеофильного характера, должны содержать сильный электронный акцептор Х.
|
|
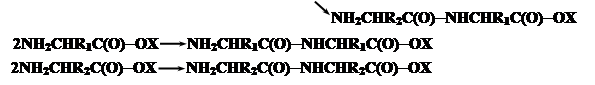
Более того из-за наличия активных групп процесс может идти дальше. Но в результате получается только статистический полимер.
|
![]()
Должна приводить к одному определенному дипипептиду. Этот пептид нереакционноспособен и для продолжения процесса необходимо удалить одну из защитных групп Z1,Z2, для того чтобы открыть либо NH2, либо СООН-группу для следующей стадии удлинения пептидной цепи. Поэтому главным требованием к защитным группам является возможность их мягкого селективного удаления, не повреждающего пептидную связь. Наиболее широко для защиты a-аминогрупп используется трет-бутилоксикарбонильная группа (Вос), которую легко ввести в аминогруппу обработкой аминокислоты соответствующим N-гидроксисукциниимидным эфиром:
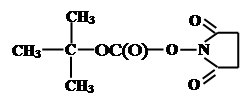 |
|
| |||
