Антигены
Конъюгированные антигены, имеющие в качестве детерминантных групп пептиды, например пептиды из D-аланина, индуцируют образование антител, реагирующих с тетра- и даже триаланином. Подобные пептиды не имеют устойчивой конформации. Следовательно, антитела в этом случае распознают лишь определенную аминокислотную последовательность. Такого типа детерминанты, получившие название секвенциальных, по-видимому, крайне редко встречаются в глобулярных белках. Даже короткие отрезки пептидных цепей глобулярных белков, с которыми реагируют антитела, например, С-концевой гептапептид многлобина, имеют определенную пространственную конформацию. Однако в фибриллярных белках есть участки пептидных цепей, лишенные вторичной структуры. Так, большая часть кроличьих антител против гетерологичного коллагена направлена против коротких неспиральных N-концевых участков цепей. Эти антитела реагируют также с N-концевыми участками полипептидных цепей денатурированного растворимого коллагена.
Одним из основных доказательств принадлежности антигенной детерминанты белка к секвенциальному типу служит наличие иммунодоминантной группы в виде концевого аминокислотного остатка. Иммунизируя кролика Fab-фрагментом аутологичного иммуноглобулина G, можно получить антитела, реагирующие только с этим фрагментом, но не с целой молекулой иммуноглобулина. Антитела практически полностью утрачивают способность реагировать с фрагментом после обработки последнего карбоксипептидазой. В использованных для протеолиза условиях от одной из пептидных цепей Fab-фрагмента отщепляется только С-концевой лейцин. Последний служит иммунодоминантной группой детерминанты секвенциального типа, находящейся в С-концевой части фрагмента.
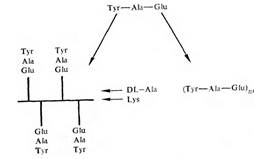
Важным подтверждением существования антител против конформационных и секвенциальных детерминант послужили эксперименты с синтетическими полипептидами, выполненные в лаборатории М. Села. Были использованы два типа пептидов, каждый из которых имел в своем составе трипептид: Туг — Ala — Glu. Один пептид обладал разветвленной структурой, будучи образован сополимером аланина и лизина, к е-аминогруппам которого апериодически были присоединены указанные трипептиды —TAG. Второй пептид представлял собой периодический полимер в форме а-спирали с формулой. Как видно из рис., при различной структуре оба полипептнда имели в своем составе блоки TAG; они характеризовались сходными молекулярными массами.*
Каждый из полипептидов был использован в качестве антигена для иммунизации кроликов. Полученные антитела не реагировали перекрестно со сравниваемыми полимерами. Трипептид—TAG блокировал реакцию между разветвленным полимером —А—L— и антителами к нему, но не влиял на реакцию n с направленными к нему антителами. В качестве гаптенов — аналогов „ — синтезировали олигопептиды с различным числом регулярно повторяющихся блоков TAG. Выраженной способностью связываться с антителами против „ обладал пептид из 9 блоков, т.е. Разветвленный полипептид на основе поли-D, L-аланина и лизина и периодический полимер
Такой петид еще не формирует устойчивой а-спирали. Но согласно данным, полученным методом циркулярного дихроизма, взаимодействие g с антителами ведет к его спирализации. Следовательно, антитела способны оказать конформирующее влияние на гаптен 13).
Совокупность данных о строении ряда белков, локализации в их молекулах детерминантных групп, общих представлений об организации антигенных детерминант белков позволили синтезировать пептиды, соответствующие детерминантным группам природных белков. Эти пептиды либо индуцировали образование антител, реагирующих с нативным белком, либо реагировали с антителами к нативному белку. Так, периодический полимер из трипептидов: Pro — Gly — Pro, формировавший характерную для коллагена тройную спираль, индуцировал образование антител, реагировавших с коллагеном, выделенным от рыб, крысы и морской свинки. На твердофазном носителе был синтезирован пептид, воспроизводящий последовательность с 64-го по 82-й остатки лизоцима из куриного яйца. Полуцистиновые остатки в позициях 64 и 80 были замкнуты в дисульфидную связь, после чего образовавшуюся петлю присоединяли к носителю в виде линейного полимера. В результате иммунизации таким антигеном были получены антитела, реагировавшие с нативным лизоцимом, а в пределах его молекулы именно с тем участком, который соответствовал синтезированной петле. В свою очередь антитела к нативному лизоциму реагировали с синтезированным пептидом. Восстановление внутрицепьевой дисульфидной связи, превращавшей синтезированный пептид в петлю, так изменяло его конформацию, что он утрачивал способность реагировать не только с антителами против нативного лизоцима, но и с антителами, полученными против того же пептида, но в виде петли. Следовательно, пептид в форме петли представляет собой типичную конформационную детерминанту.

Структура молекулы лизоцима куриного яйца. Окружностью отмечена петля полипептидной цепи, стабилизированная внутрицепьевой дисульфидной связью

Структура петли молекулы лизоцима
Оцепить размер конформационной детерминанты достаточно сложно. Ее могут образовывать аминокислотные остатки, удаленные друг от друга в первичной структуре, но сближенные в пространстве после образования третичной структуры. Так, замена двух аминокислотных остатков в молекуле легкой цепи иммуноглобулина G человека сопровождается изменением структуры только одной антигенной детерминанты. Указанные остатки находятся в двух различных петлях пептидной цепи, однако они сближены в пространстве таким способом, что контактируют между собой. Из рассматриваемого примера следует, что у конформационной детерминанты есть остов, или каркас, который стабилизирует в пространстве расположенные на поверхности молекулы боковые аминокислотные остатки, определяющие специфичность детерминанты.
Определить размер детерминант секвенциального типа значительно проще, используя, например, технику ингибирования реакции между исследуемым антигеном и антителами к нему с помощью различных по размеру.
Таблица 2. Размер секвенциальных детерминант

