Антигены
Реакцию низкомолекулярного гаптена с антителами можно оценить с помощью прямых реакций, среди которых наибольшее применение получил метод равновесного диализа. Полученные в эксперименте данные позволяют рассчитать константу равновесия в системе гаптен-антитело. Если определять величины константы равнозесия при реакции антител к определенному конъюгированному антигену с рядом сходных по строению гаптенов, можно оценить вклад каждого радикала в структуру детерминантной группы. При этом удобно сопоставлять сродство к антителу какого-то аналога детерминантной группы со сродством наиболее близкого к ней по строению гаптена. Таким способом получают относительную величину константы связывания: ДотН= = Kx/Kv.T, где Кх — константа связывания исследуемого аналога, Ср.г — константа связывания референс-гаптена.
Ниже приведены величины /Сотн для ряда нитрофе-нильных производных, реагирующих с антителами кролика против динитрофенилированного гемоцианина, т. е. степень сродства антидинитрофенильных антител кролика к различным гаптенам. Антиген получали, модифицируя белок по е-аминогруппам лизина динитрофенилсульфоно-вой кислотой. Поскольку е-динитрофениллизин наиболее близок по строению детерминантной группе использованного конъюгированного антигена, его использовали в качестве референс-гаптена.
Из анализа приведенных ниже данных следует, что антитела распознают как ДНФ-группу, так и аминокислотный остаток, к которому эта группа присоединена. При замене лизина на любую другую аминокислоту сродство антител к гаптеиу резко снижается. Даже в случае использования в качестве гаптена е-динитрофениллизина, в котором взят неприродный оптический изомер, отчетливо заметно снижение константы связывания. Особенно низкая константа связывания найдена в случае отсутствия в молекуле гаптена аминокислотного остатка (динитрофенол). Практически не связываются с изучаемыми антителами мононитрофенильные производные аминокислот. Данные были получены и для других антител к конъюгированным антигенам.

Необходимость стерического соответствия антигенной детерминанты и активного центра — антидетерминанты — антитела со всей очевидностью вытекает, в частности, из того факта, что антитела, направленные к орто-, мета- и пара-аминобензойным кислотам, практически не реагируют перекрестно. Антитела также отчетливо различают право- и левовращающие изомеры виннокаменной кислоты. Менее очевидным является факт строгой специфичности распознавания антителами р-аминобензойной и р-аминофенилсульфоновой кислот:
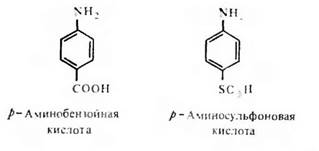
Оба ароматических соединения имеют в параположении отрицательно заряженный заместитель. Заместители отличаются степенью своей нуклеофильности, которая у сульфогруппы ощутимо выше, чем у карбоксильной группы, что приводит к более выраженному смещению облака я-электронов ароматического кольца в направлении заместителя, представленного сульфогруппой в сравнении с карбоксильной группой. Это обстоятельство и различия в размере замещающей группы достаточны, очевидно, для того, чтобы каждое соединение реагировало только с направленным к нему антителом.
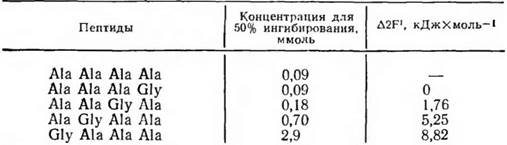
Вопрос о размере детерминантной группы конъюги-рованного антигена, вкладе в ее специфичность различных радикалов был изящно проанализирован П. Шехтером. В качестве антигена использовали конъюгаты белка с олиго-О-аланином. Реакцию между антителами к поли-О-аланину и тест-антигеном ингибировали с помощью различных по размеру олигопептидов из D- и L-аланнна. Как оказалось, ингибирующий эффект гаптенов нарастал от ди- к тетра-О-аланнну. Дальнейшее увеличение длины пептида не усиливало его ннгибирующих свойств. Тетра-Ь-аланин был совершенно не активен как ингибитор. Эти данные означают, во-первых, что антитела четко различают олигопептиды из право- и левовращающих аминокислот, не имеющие регулярной вторичной структуры. Во-вторых, очевидно, что активный центр антитела соответствует по размеру тетрапептиду.
Дальнейшие опыты показали, что вклад каждого остатка аланина в связывание тетрапептида антителом далеко не одинаков. Были синтезированы аналоги гаптена, в которых один из остатков аланина заменяли на глицин. В случае замены N-концевого аланина на глицин константа связывания такого гаптена по сравнению с тетрааланином уменьшалась в 100 раз. Напротив, замена С-концевого аналина на глицин почти не сказывалась на величине константы связывания. Поскольку пептиды присоединяли к белку-носителю через С-концевую группу, можно заключить, что решающий вклад в связывание гаптена антителом вносит наиболее удаленный от молекулы белка-носителя участок присоединенного к ней пептида: в рассматриваемом случае метильная группа N-концевого аланина. Такая группа в молекуле гаптена получила название иммунодоминантной.
Таблица 1. Исследование специфичности антител к поли-Ь-алани-ну с помощью тетрапептидов различного строения
Конъюгированные антигены оказались весьма полезными для изучения многих ключевых проблем клеточной иммунологии, вопросов регуляции иммунного ответа.
2. Белки и синтетические полипептиды
Изучение антигенной структуры белков осуществляют с помощью нескольких методов: 1) исследованием продуктов ограниченного протеолиза, 2) химической модификацией различных боковых аминокислотных остатков с последующим анализом антигенного строения образующегося продукта, 3) разрушением присущей данному белку вторичной и третичной структуры. Каждый из перечисленных методов имеет свои ограничения, в силу чего достаточно полная информация о строении детерминантных групп белков может быть получена лищь при сочетании ряда методов.
При расщеплении мономера флагеллина по остаткам метионина с помощью бромциана образуются 4 фрагмента, размер которых
приведен на рис. Фрагмент А, составляющий менее половины молекулы, имеет в своем составе все антигенные детерминанты этого белка, так как полностью ингибирует реакцию антител против нативного флагеллина с нерасщепленным флагеллином. Существенно, что указанный фрагмент в отличие от остальной части молекулы содержит относительно резистентные к действию пепсина и трипсина участки полипептидной цепи. Это согласуется с заключением, согласно которому резистентность к ферментативному гидролизу служит фактором, благоприятствующим проявлению антигенных свойств биополимера.
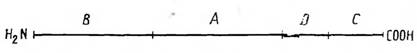
Фрагменты, образующиеся при расщеплении флагеллина бромцианом
У глобулярных белков с большим содержанием а-спиральных участков антигенные детерминанты располагаются в местах изгиба скрученной в спираль цепи. Так, в миоглобине кашалота детерминанты располагаются между остатками 15—29, 56—69, 70—76, 77—89, а также в С-концевой части молекулы. Эти данные были получены при анализе продуктов гидролиза миоглобина трипсином и химотрипсином.
Как и в молекуле миоглобине, у стафилококковой нуклеазы антигенные детерминанты расположены на поверхности молекулы преимущественно в тех участках, где между спирализованными отрезками пептидной цепи находятся неспиралнзованные участки.
