Активность плаценты при гестозах
2.2. Методы исследования
2.2.1. Метод определения активности основных карбоксипептидаз
Активность КПН определяли флюорометрическим методом Fricker и Snyder [153].
Для определения активности КПН 50 мкл гомогената ткани добавляли к 150 мкл (в случае опытной пробы) 50 мМ натрий-ацетатного буфера, рН 5,6, содержащего 50 мМ NaCl, или к смеси 140 мкл вышеуказанного буфера и 10 мкл 25 мкМ водного раствора ингибитора ГЭМЯК (в случае контрольной пробы). Далее пробы преинкубировали 8 минут при 37˚С. Реакцию начинали прибавлением 50 мкл предварительно нагретого до 37˚С 210 мкМ раствора дансил-фен-ала-арг, приготовленного на воде (конечная концентрация в реакционной смеси 42 мкМ). Пробы инкубировали 60 минут при 37˚С. Реакцию останавливали прибавлением 50 мкл 1М раствора HCl.
Для экстракции продукта реакции дансил-фен-ала к пробам приливали по 1,5 мл хлороформа, интенсивно встряхивали в течение 60 с. Хлороформную и водную фазы разделяли центрифугированием в течение 10 минут при 1000 об/мин.
Измерение флюоресценции хлороформной фазы проводили на флюориметре ФМЦ-2 при λex=360 нм и λem=530 нм в кювете толщиной 1 см. В качестве стандарта использовали 1 мкМ раствор дансил-фен-ала в хлороформе.
Активность фермента определяли как разность прироста флюоресценции в пробах, не содержащих и содержащих ГЭМЯК, и выражали в нмоль дансил-фен-ала, образовавшегося за 1 минуту инкубации в пересчете на 1 мг белка.
Для определения активности ФМСФ-ингибируемой КП 50 мкл гомогената ткани добавляли к 150 мкл (в случае опытной пробы) 50 мМ натрий-ацетатного буфера, рН 5,6, содержащего 50 мМ NaCl, или к смеси 140 мкл вышеуказанного буфера и 10 мкл 25 мМ ингибитора ФМСФ, приготовленного на этаноле, который добавляли после смешивания гомогената ткани с буфером (в случае контрольной пробы). Пробы преинкубировали 8 мин при 37˚С, затем вносили 50 мкл предварительно нагретого до 37˚С 210 мкМ раствора дансил-фен-лей-арг, приготовленного на воде. Далее пробы обрабатывали как описано для КПH. Активность фермента определяли как разницу в приросте флюоресценции в пробах, не содержащих и содержащих ФМСФ и выражали в нмоль дансил-фен-лей, образовавшегося за 1 мин инкубации в пересчете на 1 мг белка.
Концентрацию белка определяли методом Лоури [80].
2.2.2 Метод определения каталазы
В две колбы наливали по 7 мл дистиллированной воды и добавляли в них по 1 мл гомогената. Содержимое кипятили 2 - 3 мин. В обе вносили по 2 мл 1% H2O2 и оставляли на 30 мин при комнатной температуре. Затем приливали по 5 мл 10% H2SO4 и оттитровывали содержимое 0,05н KMnO4 до розового цвета.
Расчет: 1мл 0,05 н KMnO4 — 0,85 г H2O2. Таким образом, разницу в результатах титрования контроля и опыта умножаем на эту величину, получали количество мг перекиси.
2.2.3 Метод определения активности церулоплазмина
Активность церулоплазмина определяли модифицированным методом Ревина, который базируется на окислении p-фенилендиамина при участии этого фермента. Ферментативную реакцию останавливают добавлением фтористого натрия. По оптической плотности образующихся продуктов судят о концентрации церулоплазмина.
В обычные химические пробирки вносили по 0,1 мл гомогената. В одну из пробирок, служащую контрольной, добавляли 2 мл раствора фтористого натрия (с целью инактивации ферментативной активности церулоплазмина). Затем во все пробирки помещали по 8 мл ацетатного буфера и по 1 мл раствора p-фенилендиамина (используемого в качестве субстрата). Пробирки встряхивали и ставили на 1ч в водяную баню с температурой +37˚С. После инкубации во все пробирки, за исключением контрольной, доливали по 2 мл раствора фтористого натрия. Содержимое пробирок перемешивали и переносили в холодильник, где выдерживали в течение 30 мин при +4˚С. Пробы колориметрировали на ФЭКе с зеленым светофильтром (530нм) в кюветах с шириной слоя 10 мм. Результаты сравнивали с данными контрольной пробы (бледно-розовая окраска). Умножали значения оптической плотности на коэффициент пересчета 875, получали величину концентрации церулоплазмина в мг/л.
2.2.4. Метод определения уровня продуктов перекисного окисления липидов (диеновых и триеновых конъюгатов)
Для экстракции липидов брали 1 мл 25% гомогената плацентарной ткани, приливали 3 мл метанола, перемешивали стеклянной палочкой, встряхивали в течение 15 мин, затем центрифугировали при 3000 об/мин в течение 5 мин. Добавляли 3 мл гексана, вновь тщательно перемешивали стеклянной палочкой, встряхивали в течение 15 мин и оставляли отстаиваться на 30 мин. После разделения слоев, верхний (метанол-гексановый слой) отбирали в сухую пробирку и использовали для исследований.
Уровень диеновых конъюгатов определяли спектрофотометрически при длине волны 233 нм, кетодиенов и сопряженных триенов – при длине волны 278 нм, ненасыщенных липидов – при длине волны 220 нм. Рассчитывали содержание диеновых конъюгатов, кетодиенов и сопряженных триенов по отношению к уровню ненасыщенных липидов (E233/E220 и E278/E220).
2.2.5 Метод определения уровня гидроперекисей
Для приготовления гомогената использовали буфер 0,025 М трис HCl (pH 7,4), содержащий 0,175 М хлорида калия. Гомогенат (25%) по 2 мл помещают в центрифужные пробирки и осаждают белок добавлением 0,2 мл 50%-ного раствора ТХУ.
Образующийся осадок отделяют центрифугированием в течение 10 мин. при 4000g. 2 лм надосадочной жидкости доводят 96% этанолом до 27 мл. К равным объемам до 27 мл добавляют 0,2 мл концентрированной соляной кислоты и 0,025 мл 5%-ного раствора соли Мора в 3%-ной соляной кислоте, пробы интенсивно встряхивают. Точно через 30с приливают 1мл 20%-ного раствора роданистого калия, после чего развивается малиновая окраска. В качестве контроля используют пробы, содержащие 96%-ный этанол вместо НЖ. Изменение оптической плотности проводят в течение 10 мин. после добавления роданистого калия при 480 нм.
2.2.6 Статистическая обработка результатов исследования
Достоверность отличий между средними определяли с использованием t-критерия Стьюдента. Корреляционный анализ проводили с помощью программы Statgraphics (версия 3.0) (“STSC, Inc.” США) в режимах Simple Correlation.
Глава 3. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
3.1. Активность КПН и ФМСФ-ингибируемой карбоксипептидазы в плацентарной ткани в норме и при ОПГ-гестозе легкой степени тяжести
Результаты исследования показали достоверное снижение активности КПH и ФМСФ-КП в плацентарной ткани при ОПГ-гестозе легкой степени тяжести в 2 раза по сравнению с нормой (рисунок 1, 2).
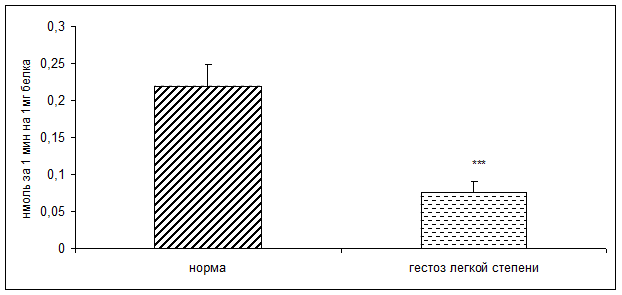
Рисунок 1. Активность карбоксипептидазы H в норме и при ОПГ-гестозе легкой степени тяжести (нмоль продукта, образовавшегося за 1мин инкубации на 1мг белка; M±m; *** - p<0,001 относительно нормы)
По данным корреляционного анализа выявлена положительная взаимосвязь между активностью КПН и ФМСФ-КП в плацентарной ткани. Уменьшение активности КПH согласуется с данными литературы о снижении концентрации белковых гормонов в фетоплацентарном комплексе (ФПК) при ОПГ-гестозах [7,8,9,11,12,13]. Наиболее важными из них являются хорионический гонадотропин, плацентарный лактоген, пролактин, инсулин, инсулиноподобные факторы роста, C – пептид и др.
