Производство стали
Окисление углерода. Особенность окисления углерода заключается в том, что продуктом этой реакции является газообразный СО, который, выделяясь из металлической ванны в виде пузырей, создает впечатление кипящей жидкости. Реакцию окисления углерода, растворенного в металле можно написать в следующем виде:
[C] + [O] = {CO}; K = ![]()
где [C]; [O] - концентрации растворенных в металле углерода и кислорода.
Как следует из уравнения для константы, при заданном значении рсо произведение концентрации углерода и растворенного кислорода есть величина постоянная. Следовательно, от концентрации углерода зависит концентрация кислорода в металле. Чем выше содержание углерода в металле, тем ниже содержание кислорода в нем и наоборот.
Окисление и восстановление марганца. Марганец как элемент, обладающий высоким сродством к кислороду, легко окисляется как при кислом, так и при основном процессах. Реакции окисления и восстановления марганца можно представить следующим образом:
[Mn] + [O] ![]() (MnO); [Mn] + (FeO)
(MnO); [Mn] + (FeO) ![]() (MnO) + [Fe]
(MnO) + [Fe]
Как показывают расчетные и экспериментальные данные, с повышением температуры и основности шлака концентрация марганца в металле увеличивается. Это указывает на то, что реакция окисления марганца достигает равновесия, и окислительный процесс сменяется восстановительным. Поскольку почти все стали содержат марганец, то его восстановление в процессах плавки - явление желательное.
Окисление и восстановление кремния. Кремний обладает еще большим сродством к кислороду, чем марганец, и практически полностью окисляется уже в период плавления. Окисление кремния происходит по реакциям:
[Si] + 2[O] = (SiO2); [Si] + 2(FeO) = (SiO2) + 2 [Fe]
При плавке под основным шлаком SiO2 связывается в прочный силикат кальция (CaO)2•SiO2, что обеспечивает почти полное окисление кремния, содержащегося в шихте. При кислом процессе поведения кремния иное: при горячем ходе кислого процесса имеет место интенсивное восстановление кремния.
Окисление и восстановление фосфора. Фосфор в стали является вредной примесью, отрицательно влияющей на ее механические свойства. Поэтому содержание фосфора в стали в зависимости от ее назначения ограничивается пределом 0,015 - 0,016 %. Окисление фосфора можно представить следующим образом:
2[P] + 5(FeO) = (P2O5) + 5[Fe];
(P2O5) + 3(FeO) = (FeO)3• P2O5;
(FeO)3•P2O5 + 4(CaO) = (CaO)4•P2O5 + 3(FeO);
2P + 5(FeO) + 4(CaO) = (CaO)4•P2O5 + 5Fe.
Уравнение константы можно записать в следующем виде:
K = ![]()
Откуда коэффициент распределения фосфора между металлом и шлаком:
L = (P2O5)/P2 = K![]() (FeO)5
(FeO)5 ![]() (CaO)4
(CaO)4
Десульфация стали. Сера, также как и фосфор, является вредной примесью в стали. Удаление серы можно представить в виде реакции
Feж + [S] +(CaO) = (CaS) + (FeO).
Уравнение для константы имеет вид:
К = ![]()
Коэффициент распределения серы
L = (S)/[S] = K(CaO)/(FeO).
Из уравнения следует, что повышение основности и снижение окисленности шлака способствует десульфации. Положительную роль оказывает также повышение температуры металла и активное перемешивание ванны. Повышению степени удалении серы способствуют элементы, образующие сульфиды, более прочные, чем сульфид железа. К таким элементам относятся редкоземельные металлы.
Газы в стали. Газы (кислород, водород и азот) содержаться в любой стали. Газы даже при содержании их в сотых и тысячных долях процента оказывают отрицательное влияние на свойства металла.
Растворимость кислорода в стали характеризуется реакцией: ![]() .
.
В готовом металле содержание кислорода должно быть минимальным.
Растворимость водорода и азота в металле починяется закону Стивенса:
![]() ;
; ![]() , где pH и pN - парциальные давления газов; KH и KN - растворимость водорода и азота при парциальном давлении соответствующего газа равном, 0,1 МПа.
, где pH и pN - парциальные давления газов; KH и KN - растворимость водорода и азота при парциальном давлении соответствующего газа равном, 0,1 МПа.
Уменьшение растворимости при переходе из жидкого в твердое состояние при кристаллизации стали вызывает выделение газов из металла, что является причиной образования ряда дефектов, например, флокенов[1], пористости в слитках готовой стали и т. п. В присутствии некоторых элементов в металле могут образовываться их соединения с азотом - нитриды. Наличие нитридов в кристаллической структуре многих сталей отрицательно влияет на свойства металла.
Азот и водород успешно удаляются из жидкой стали в результате реакции окисления углерода. Образующийся по этой реакции СО, собирается в пузырьки, которые вырываются на поверхность металла, пробивают находящийся под металлов слой жидкого шлака и выходят в атмосферу. В результате этого создается впечатление кипения жидкой ванны.
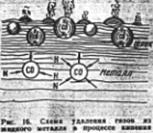 Всплывающие пузырьки СО захватывают по пути вверх некоторое количество других газов - H2 и N2 (рис 1).
Всплывающие пузырьки СО захватывают по пути вверх некоторое количество других газов - H2 и N2 (рис 1).
Чем энергичнее протекает кипение металла, тем меньше содержание газов и тем лучше качество металла. Для удаления H2 и N2 применяют также вакуумную обработку, продувку ванны нейтральным газом (аргоном) и др.
Рис. 1 Схема удаления газов из
жидкого металла в процессе кипения
Раскисление стали. Для снижения содержания кислорода в стали проводят ее раскисление. Это, как правило, последняя и ответственная операция в процессе выплавки стали. Раскисление - это процесс удаления кислорода, растворенного в стали, путем связывания его в оксиды различных металлов, имеющих большее сродство к кислороду, чем железо.
Наиболее распространенными раскислителями являются марганец и кремний, используемые в виде ферросплавов, и алюминий.
Реакции раскисления можно представить следующим образом:
[O] + [Mn] = (MnO)
2[O] + [Si] = (SiO2)
3[O] + 2[Al] = (Al2O3)
В зависимости от условий ввода раскислителей в металл различают два метода раскисления: глубинное (или осаждающее) и диффузионное раскисление.
При глубинном раскислении раскислители вводят в глубину металла. В этом случае требуется определенное время для того, чтобы продукты раскисления - оксиды кремния, марганца, алюминия всплыли в шлак. При диффузном раскилении раскислители в тонко измельченном виде попадают в шлак, покрывающий металл. Сначала в этом случае происходит раскисление шлака, а снижение содержания кислорода в металле происходит за счет его перехода из металла в шлак, т. е. [O] ==> (O). При диффузионном раскислении не происходит загрязнение металла неметаллическими включениями - продуктами раскисления.
