Белки: история исследования, химсостав, свойства, биологические функции
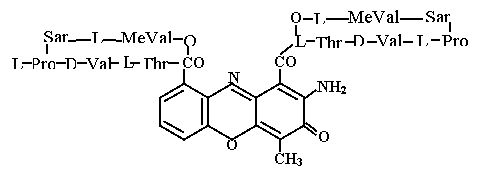
Интенсивно исследуются антибиотики, взаимодействующие с ДНК и этим нарушающие процессы, связанные с реализацией заложенной в ней наследственной информацией. Антибиотики с таким механизмом действия обычно высокотоксичны и используются только в химотерапии злокачественных опухолей. В качестве примера можно привести актиномицин D:
 |
8) Токсины :
Ряд живых организмов в качестве защиты от потенциальных врагов вырабатывают сильно ядовитые вещества - токсины. Многие из них являются белками, однако, встречаются среди них и сложные низкомолекулярные органические молекулы. В качестве примера такого вещества можно привести ядовитое начало бледной поганки - a-аманитин:
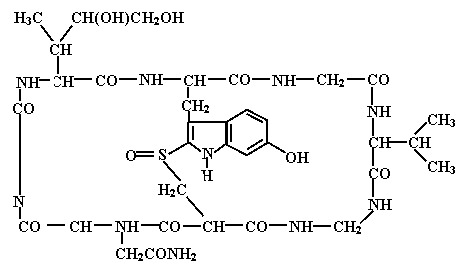
Это соединение специфично блокирует синтез эукариотических и-РНК. Для человека смертельной дозой является несколько мг этого токсина.
Глава 10. Заключение.
В последние десятилетия изменился сам подход к решению основополагающих проблем биологии. Один из основателей молекулярной биологии, английский ученый, лауреат Нобелевской премии Джон Кендрью сказал: “Биологи прежних лет в целом продвигались сверху вниз. Они начинали с целого организма, потом разнимали его на части и рассматривали отдельные органы и ткани; далее они изучали отдельные клетки под микроскопом - так мало-помалу они продвигались вниз от сложного к простому. Новая биология начинает с другого конца и продвигается с самого низа вверх. Она начала с простейших компонентов живого организма - стала изучать отдельные молекулы и их взаимодействие внутри клеток, пренебрегая всем остальным. Теперь пришла пора обратиться к этому остальному и двигаться вдоль иерархии биологической организации”.
Однако биология, сложнейшая необъятная наука, отнюдь не сводится к молекулярной биологии или биоорганической химии. Они представляют собой лишь подходы к решению некоторых биологических задач. За последние четверть века на этом пути были сделаны блестящие, иногда даже сенсационные открытия. Есть все основания полагать, что череда этих открытий еще не закончилась, как не закончилась еще революция в биологии.
Список литературы:
1. В.Т.Иванов, А.Н.Шамин. Путь к синтезу белка. - Ленинград: Химия, Ленинградское отделение, 1982 г.
2. Д.Г.Кнорре, С.Д.Мызина. Биологическая химия. - М.: Высшая школа, 1998 г.
3. Р. Марри, Д. Греннер. Биохимия человека. Т. 1-2 . - М.: Мир, 1993 г.
4. А.Уайт, Ф.Хендлер. Основы биохимии. Т. 1-3. - М.: Мир, 1981 г.
5. Б.Албертс, Д.Брей. Молекулярная биология клетки. Т. 1-3. М.: Мир, 1994 г.
6. Г.Шульц, Р.Ширмер. Принципы структурной организации белков. - М.: Мир, 1982 г.
7. А.О.Рувинский, В.К. Шумной. Общая биология. - М.: Просвещение, 1995 г.
8. Н.Н.Приходченко, Т.П.Шкурат. Основы генетики человека. - Ростов‑на-Дону: Феникс, 1997 г.
9. В.Н.Ярыгин. Биология. Т. 1-2. - М.: Высшая школа, 1999 г.
ПРИЛОЖЕНИЕ
Приложение I
|
Аминокислота | Формула | Сокращение | ||||
| 3-х букв | 1 букв. | |||||
|
Алифатические аминокислоты Моноаминомонокарбоновые кислоты | ||||||
|
1. Глицин (гликокол) аминоуксусная к-та |
H –CH – COOH | NH2 |
Gly | G | |||
|
2. Аланин, a-амино-пропионовая к-та |
CH3 –CH – COOH | NH2 |
Ala | A | |||
|
3. Валин, a-амино-изовалериановая к-та |
CH3 – CH –CH – COOH | | CH3 NH2 |
Val | V | |||
|
4. Лейцин, a-амино-изокапроновая к-та |
CH3 – CH - СH2 –CH – COOH | | CH3 NH2 |
Leu | L | |||
|
5.Изолейцин, a-амино- изокапроновая к-та |
CH3 – CH2 - СH –CH – COOH | | CH3 NH2 |
Ile | I | |||
|
6. Серин, a-амино-b-гидроксипропионовая к-та |
CH2 –CH – COOH | | OH NH2 |
Ser | S | |||
|
7. Треонин, a-амино--b-гидроксимасляная к-та |
CH3 – CH –CH – COOH | | OH NH2 |
Thr | T | |||
|
Диаминомонокарбновые кислоты | ||||||
|
8. Лизин, a,e,-диаминокапроновая к-та |
NH2 - CH2 - CH2 – CH2 - СH 2 –CH – COOH | NH2 |
Lys | K | |||
|
9. Гидрокси- лизин (модификация лизина) |
NH2 - CH2 – CH – CH2 - СH 2 –CH – COOH | | OH NH2 |
Hyl | ||||
|
10. Аргинин, a-амино-s-гуаниди- валериановая к-та |
NH2 - C – NH – CH2 – CH2 - СH 2 –CH – COOH | | | N NH2 |
Arg | R | |||
|
Моноаминодикарбоновые кислоты и их амиды | ||||||
|
11. Аспарагиновая к-та, a-аминоянтарная к-та |
HOOC – CH2 –CH – COOH | NH2 |
Asp | D | |||
|
12.Аспарагин, |
NH2 - CO – CH2 –CH – COOH | NH2 |
Asn | N | |||
|
13. Глутаминовая к-та, a-амино- глутаровая к-та |
HOOC – CH2 – CH2 –CH – COOH | NH2 |
Glu |
E | |||
|
13.Глутамин, |
NH2 – CO – CH2 – CH2 –CH – COOH | NH2 |
Gln, Glu | NH2 | Q | |||
|
Серусодержащие аминокислоты | ||||||
|
14. Цистеин, a-амино-b-тиопропионовая к-та |
HS – CH2 –CH – COOH | NH2 |
Cys | C | |||
|
15. Цистин (модификация цистеина) |
NH2 | S – CH2 – CH – COOH | S – CH2 –CH – COOH | NH2 |
Cys | Cys | C | C | |||
|
16.Метионин, a-амино-g-тиометил-масляная к-та |
СH3 – S – СH2 – CH2 –CH – COOH | NH2 |
Met | M | |||
|
пропионовая к-та |
СH2 – CH – COOH | NH2 |
Phe | F | |||
|
аланин |
HO – – CH2 – CH – COOH | NH2 |
Tyr | Y | |||
|
|
CH2 – CH – COOH | NH2 |
Try, Trp | W | |||
|
к-та |
N CH2 – CH – COOH | NH NH2 |
His | H | |||
|
Иминокислоты | ||||||
|
|
- СOOH NH |
Pro | P | |||

 17.Фенилаланин, a-амино-b-фенил-
17.Фенилаланин, a-амино-b-фенил-


 20. Гистидин, a-амино-b-имида-золилпропионовая
20. Гистидин, a-амино-b-имида-золилпропионовая