Экспрессия генов
РНК-полимераза I эукариот (Pol I). Как и большинство других высокомолекулярных полипептидов, большие субъединицы РНК-полимераз содержат хорошо различимые структурные и функциональные домены:дискретные участки полипептидных цепей, несущие конкретную функциональную нагрузку. Клонирование генов соответствующих субъединиц и определение их первичной структуры позволили выявить эволюционно консервативные участки полипептидных цепей и провести мутационный анализ функциональной значимости их отдельных доменов. Для этой цели в
Рис. I.4. Структурные и функциональные домены больших субъединиц эукариотической РНК-полимеразы I (а) и особенности структуры промоторов эубактерий и эукариот (б)
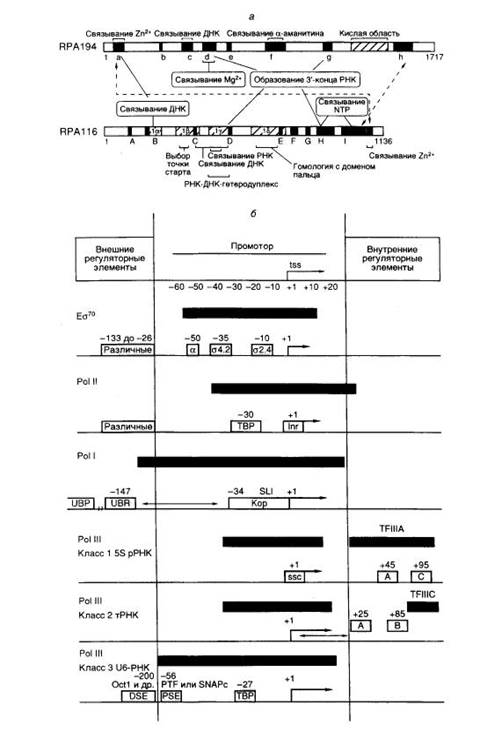
а – Полипептидные цепи двух больших субъединиц изображены в виде горизонтальных прямоугольников, в которых черным цветом и латинскими буквами отмечены участки, консервативные у большинства известных РНК-полимераз. Кислая область и участки Iα-Iδ характерны для РНК-полимераз I. Обозначены зоны полипептидных цепей, формирующие активный центр фермента и необходимые для выполнения соответствующих функций (например связывания Mg2+). Пунктирные стрелки указывают на участки субъединиц, контактирующие друг с другом. Незаштрихованными прямоугольниками обозначены известные структурные элементы промоторов, необходимые для инициации или активации транскрипции. Внутри прямоугольников приведены названия факторов транскрипции, взаимодействующих с соответствующими элементами промоторов, а также названия сайтов или взаимодействующих с ними белков, находящихся над сайтами. Стрелки ↔ обозначают фиксированные расстояния между элементами промоторов, а → – 5′-концевые части элонгируемых транскриптов. Черными прямоугольниками обозначены участки промоторов, защищаемые от действия ДНКазы I или других агентов Eσ70, а также эукариотическими транскрипционными комплексами, обеспечивающими базальный уровень транскрипции. tss – точка инициации транскрипции.
Pol I мышей, которые являются функциональными аналогами β'- и β- субъединиц РНК-полимеразы E. coli. РНК-полимераза I эукариот является большим ферментом, построенным по меньшей мере из 11 субъединиц. Минимальный фермент Pol I содержит два обсуждавшихся выше больших полипептида с молекулярной массой 194 и 116 кДа, которые ассоциированы с несколькими малыми субъединицами (от трех до 14 в зависимости от метода очистки), молекулярные массы которых лежат в пределах 15–60 кДа. Третья по величине субъединица Pol I мышей с молекулярной массой 53 кДа, названная PAF53 (polymerase associated factor 53), играет важную роль в узнавании Pol I своих промоторов и, по-видимому, является структурным и функциональным аналогом белка RPA49 дрожжей. Pol I дрожжей в отсутствие субъединиц RPA49 и RPA35.5 (так называемая Pol I*) эффективно транскрибирует при низких концентрациях солей искусственную матрицу poly[d(A-T)], но не нативную двухцепочечную ДНК.
Полагают, что эти субъединицы необходимы для эффективного образования инициационных комплексов.
Используя антитела к отдельным субъединицам Pol I и последующую иммунопреципитацию, установили, что в клетке, по крайней мере, часть Pol I находится в составе больших комплексов, с которыми ассоциированы факторы транскрипции. Пять компонентов такого холофермента Pol I изучены в настоящее время наиболее детально. Мышиный фактор TIF-IB (Pol I-specific transcription initiation factor B), известный также, как фактор D, обеспечивает Pol I селективность в отношении промоторов генов рРНК (рДНК). Аналогичный белок у человека назван hSL1, у крыс – rSL1 и у X. laevis – Rib 1. Взаимодействие фактора TIF-IB/SL1 с промотором рДНК обеспечивает связь холофермента Pol I с промотором и сборку прединициационного комплекса. Фактор TIF-IB/SL1 состоит из четырех субъединиц, одна из которых является основным фактором транскрипции TBP, необходимым для функционирования РНК-полимераз всех трех классов. Три других субъединицы с молекулярными массами 110, 63 и 48 кДа представляют собой разные TBP-ассоциированные факторы TAFI, индивидуально и специфически взаимодействующие с TBP, а также друг с другом, образуя прочный комплекс. В составе комплекса TAFI48 обеспечивает контакт TIF-IB/SL1 с фактором UBF (см. ниже), а TAFI63 и TAFI110 участвуют в распознавании промотора. Факторы TAFI не обнаруживают гомологии с соответствующими факторами TAFII, специфичными в отношении Pol II. Более того, первый из связавшихся с TBP факторов TAFI предотвращает взаимодействие с TBP факторов TAFII (и наоборот), что делает невозможным образование непродуктивных химерных комплексов. Одновременно взаимодействие TAFI48 с TBP изменяет ДНК-связывающие свойства последнего, после чего тот перестает узнавать TATA-бокс – характерный структурный элемент Pol II-промоторов, и, следовательно, теряет способность обеспечивать инициацию транскрипции Pol II. Другой белок, входящий в состав холофермента Pol I, UBF (upstream binding factor) высоко консервативен у разных видов животных. UBF является членом семейства факторов транскрипции, содержащих ДНК-связывающий HMG-домен (high mobility group domain) – основную последовательность из 80 аминокислот. С помощью ЯМР-спектроскопии установлено, что полипептидная цепь HMG-домена организована в три α-спирали, расположенные в виде буквы L, которые формируют три ДНК-связывающих поверхности с внешней стороны L. В клетке UBF присутствуют в двух формах – UBF1 и UBF2 с молекулярными массами 97 и 95 кДа, которые образуются в результате альтернативного сплайсинга. UBF1 содержит пять HMG-доменов, фланкированных N-концевым димеризующим мотивом и короткой кислой C-концевой последовательностью. Интересно, что соседние HMG-домены одного и того же UBF обладают гораздо меньшей гомологией, чем соответствующие домены UBF разных видов (например шпорцевой лягушки и человека). Полагают, что каждый HMG-домен обеспечивает особую, эволюционно консервативную функцию молекулы UBF. Такими функциями могут быть распознавание специфических последовательностей ДНК, создание молекулярных интерфейсов для белок–белковых взаимодействий между Pol I и TIF-IB/SL1, а также различными репрессорами и активаторами транскрипции рДНК. С-Концевая последовательность UBF содержит несколько фосфорилируемых остатков Ser и необходима для активации транскрипции рДНК. Одной из основных характеристик белков, содержащих HMG-бокс, является их способность изгибать молекулу ДНК и прочно связываться с ее крестообразными структурами. Всеми этими свойствами обладает UBF, и они детально исследованы. Белок CPBF (core promoter binding factor), выделенный из асцитных клеток аденокарциномы молочных желез крыс, специфически взаимодействует с коровым участком промотора рДНК. CPBF, прочно взаимодействующий с Pol I, состоит из двух субъединиц USF1 и USF2 с молекулярными массами 44 и 39 кДа соответственно. Гомодимеры USF1 и USF2 являются сильными ингибиторами транскрипции Pol I, тогда как гетеродимеры USF1/USF2 стимулируют транскрипцию in vitro.Полагают, что CPBF участвует в регуляции транскрипции Pol I in vivo. TIF-IA – другой компонент холофермента Pol I, также участвует в регуляции синтеза рРНК этим ферментом. В его отсутствие инициационный комплекс не может образовывать первой фосфодиэфирной связи, а следовательно, и инициировать синтез РНК. TIF-IA освобождается после инициации транскрипции и может вновь входить в состав собирающихся прединициационных комплексов. По этим и ряду других критериев TIF-IA рассматривают в качестве функционального аналога бактериального фактора σ70. TIF-IA является мономерным глобулярным белком с молекулярной массой 70–80 кДа. Активность этого фактора или его внутриклеточное содержание уменьшается при подавлении синтеза белка, истощении сыворотки или дифференцировке клеток и возрастает в ответ на митогенные стимулы, что коррелирует с подавлением или стимуляцией синтеза рРНК. Хроматографически и с помощью иммунопреципитации было установлено, что жизненно важный фактор TIF-IC в растворе ассоциирован с Pol I. Этот фактор необходим как для сборки инициационных комплексов, так и образования первой фосфодиэфирной связи. Его присутствие предотвращает неспецифическую инициацию транскрипции и ее преждевременную терминацию, что проявляется в образовании гомогенных транскриптов правильной длины. По этим критериям фактор TIF-IC рассматривают в качестве функционального аналога TFIIF (RAP30/74) Pol II.
