Страница
3
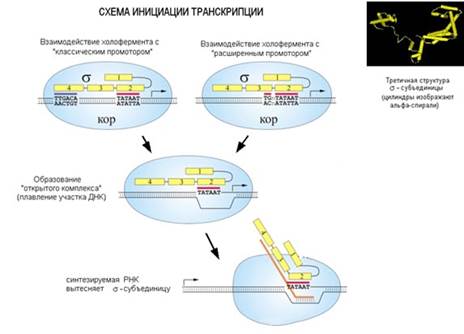
Эта структура называется расширенным промотором. σ-субъединица РНК-полимеразы садится на промотор в ДНК и разными частями белковой молекулы взаимодействует с частями промотора. Распознает его σ-субъединица через большую бороздку ДНК. После того, как σ-субъединица в составе кор-фермента связалась с промотором, ДНК на этом участке начинает плавиться (расплетаются нити ДНК). На прошлой лекции обсуждалось, что в паре А-Т связи между нуклеотидами разрываются легче, чем в паре Г-Ц, так как последняя содержит 3 водородных связи, а первая – две. Промотор содержит пары А-Т, поэтому плавится он достаточно легко. И затем начинается синтез РНК, растущая цепь РНК выталкивает σ-субъединицу и происходят еще другие изменения, которые вызывают диссоциацию σ-субъединицы от кор-фермента.
Теперь приведем пример, как изучают функции разных частей белка. Если небольшой кусочек белка отрезать и посмотреть, как изменились функции белка, то можно понять, какие были функции у отрезанного кусочка. В нашем случае сделали по-другому. Взяли две ДНК-полимеразы, одну взяли из кишечной палочки, а другую – из теплолюбивой бактерии (термофильной), которая растет при 800 С, (в лабораторных условиях их растят в колбе, которая находится в термостате в почти кипящей воде, в естественных условиях они живут в горячих источниках, есть такие, которые могут жить при 98оС), следовательно оптимум работы ее РНК-полимеразы и σ-субъединицы – 80оС, (на рисунке σ-субъединица термофильной бактерии показана красным, а кишечной палочки - желтым), а у кишечной палочки наиболее эффективная работа идет при температуре человеческого тела, (так как она живет в кишечнике). У ее σ-субъединицы всего четыре части, разрезали белок и сшивали эту σ-субъединицу с кусочком от σ-субъединицы термофильной бактерии. И потом разные кусочки от термофильной бактерии вставляли, заменяя ими разные фрагменты σ-субъединицы. Затем смотрели, активен ли полученный гибридный белок при 200 С или нет. Термофильная бактерия при такой температуре не работает, для нее это слишком холодно, а кишечная палочка активна. На рисунке видно, что при данной температуре работает только та комбинация, при которой у σ-субъединицы первая и вторая часть от кишечной палочки, а третья и четвертая от термофильной бактерии. Таким образом, делают вывод, что температуру работы σ-субъединицы определяют первая и вторая составные части.
На самом деле разрезают не белок, а ДНК, потом кусочки ДНК от разных бактерий сшивают вместе и затем вводят в бактерию, там при активизации этой части ДНК синтезируется гибридный белок. Эта технология относится к генной инженерии, она была разработана в 70-х годах.
Еще одной особенностью транскрипции является то, что кор-фермент бактериальной клетки один и тот же, а σ-субъединицы могут быть разными. У кишечной палочки всего 7 σ-субъединиц, они узнают разные промоторы. Зачем это нужно? Если клетке срочно нужно переключить синтез белков с одной группы генов на другую, она может использовать разные σ-субъединицы. Например, есть гены теплового шока, если кишечную палочку подогреть до состояния, когда жить ей станет очень тяжело, она включает аварийную систему сопротивления тепловому шоку, сопротивления тем разрушениям, которые произошли в клетке. В эту систему входит тот набор генов, который в норме работать не должен, перед этими генами свой особый промотор. И тогда другая σ-субъединица , не основная, синтезируется и активирует эти гены. То есть смена субъединицы – это смена программы работы генов. Это способ регуляции работы генов.
Трансляция
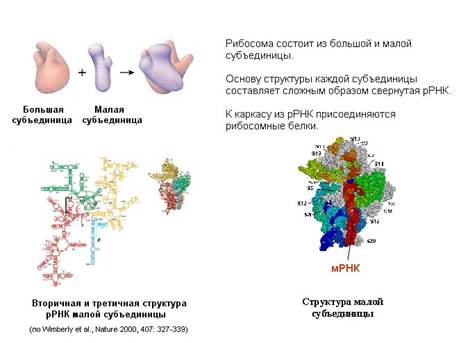
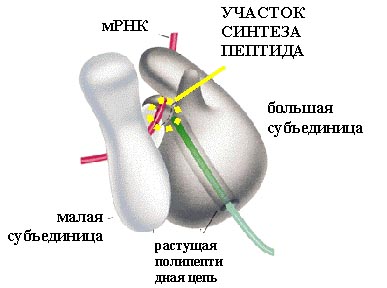
Перейдем к трансляции – синтезу белков. Она проводится рибосомами. Рибосома состоит из двух субчастиц: большой и малой.
Каждая субчастица состоит из нескольких десятков белков, каждый из которых уже изучен, известно, каким образом каждый белок уложен в субчастицу. При исследовании белков используют метод электрофореза, то есть в электрическом поле в специальном геле или специальном носителе молекулы белков разъединяются в зависимости от их заряда и молекулярного веса, то есть под действием поля они начинают двигаться и могут отодвигаться друг от друга на разное расстояние. Другим методом разделения белков является хроматография, в результате этого метода на носителе получают пятнышки, каждый из которых соответствует отдельному белку.
Белки в рибосоме держатся на каркасе, состоящем из рибосомной РНК. Формирование рибосомы начинается с того, что рибосомная РНК сворачивается и на нее в определенном порядке начинают налипать белки. На рисунке представлена рибосомная РНК. В ней самокомплементарные участки нити РНК спариваются, образуя шпильки (вторичная структура), и затем РНК сворачивается (третичная структура РНК), образуя каркас субчастиц.
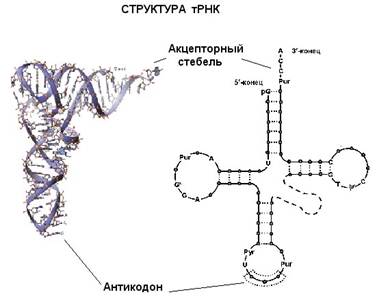
Еще один вид РНК, участвующей в синтезе белка, это транспортная РНК (тРНК). Молекулы тРНК относительно небольшие (по сравнению с рибосомногй или матричной РНК). Все тРНК имеют общую вторичную структуру. За счет спаривания комплементарных участков молекулы тРНК образуется три "стебля" с петлями на концах и один "стебель", образованный 5'- и 3'-концами молекулы тРНК (иногда образуется еще дополнительная пятая петля). Изображение этой структуры похоже на крест или клеверный лист. "Голова" на этом листе представлена антикодонной петлей, здесь находится антикодо – те три нуклеотида, которые комплементарно взаимодействуют с кодоном в мРНК. Противоположный антикодонной петле стебель, образованный концами молекулы, называется акцепторным стеблем – сюда присоединяется соответствующая аминокислота. Распознают подходящие друг другу тРНК и аминокислоты специальные ферменты, называемые аминоацил-тРНК синтетазами. Для каждой аминокислоты есть своя аминоацил-тРНК синтетаза.
В рибосоме находится матричная РНК (мРНК). С кодоном (тремя нуклеотидами) мРНК комплементарно связан антикодон транспортной РНК, на которой висит остаток аминокислоты. На рисунке видна такая структура (тРНК вместе с аминокислотой, которая называется аминоцил-тРНК).
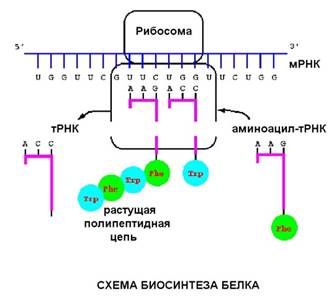
Процесс трансляции, также как и процесс транскрипции, связан с перемещением вдоль молекулы нуклеиновой кислоты, разница в том, что рибосома шагает на три нуклеотида, в то время как РНК-полимераза - на один.
Аминоцил т-РНК входит в рибосому, комплементарно связываясь с кодоном мРНК, затем происходит реакция при которой аминокислотные остатки связываются друг с другом, а т-РНК удаляется.
"Словарь" для перевода с языка нуклеотидов на язык аминокислот называется генетическим кодом. Аминокислот - 20, нуклеотидов – 4, число комбинаций из 4 по 2 = 16, а аминокислот 20, поэтому кодировка не двух, а трехбуквенная, каждая тройка называется кодоном. Каждая аминокислота кодируется тремя нуклеотидами в мРНК (которая, в свою очередь, кодируется ДНК).
