Семейство хеморепеллентов, семафорины
Исследования Фишбаха, Кохена, Шанге, Салпетера, Штайнбаха, Пу, Кидокоро и других показали, что на ранних периодах развития рецепторы АХ распределены диффузно вдоль поверхности неиннервированных мышечных волокон с плотностью около нескольких сотен рецепторов на квадратный миллиметр. По мере того как конус роста мотонейрона приближается к мышечному волокну, в клетке-мишени возникают деполяризующие потенциалы в ответ на выделение АХ из конуса роста (рис. 3.). После контакта частота спонтанного выделения квантов АХ быстро возрастает, как и величина синаптического потенциала, возникающего в ответ на стимуляцию аксона. Таким образом, в течение минут формируется функциональная сииаптическая связь.
На первом этапе синаптической специализации происходит накопление рецепторов АХ (AChRs) непосредственно под терминалью аксона. Этот процесс начинается через несколько часов после первоначального контакта. Через день-два плотность рецепторов под терминалью составляет несколько тысяч на квадратный миллиметр. Примерно в то же самое время в областях синапсов начинает накапливаться ацетилхолинэстераза и становятся заметны пучки матрикса пластинки в области синаптической щели. Дальнейшая дифференцпровка нервно-мышечного соединения происходит постепенно, в течение нескольких последующих недель развития. У многих видов субъединица рецептора АХ заменяется на субъединицу, что приводит к формированию из эмбрионального рецептора рецептора взрослого типа (глава 3). Распределение рецепторов также меняется: концентрация под терминалью аксона постепенно увеличивается, достигая у взрослых уровня примерно 104 рецепторов на 1 мкм2, а плотность рецепторов вне синаптической зоны мышечных волокон уменьшается до уровня меньше чем 10 рецепторов на I мкм2. Метаболическая стабильность рецепторов АХ также меняется. До иннервации рецепторы мембраны имели период полужизни порядка 1 дня; рецепторы АХ в иннервированных волокнах удивительно стойкие, их период полужизни составляет около 10 дней.
|
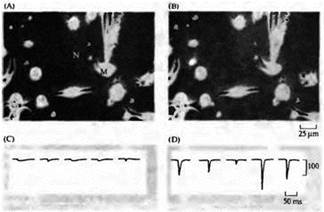
Рис. Быстрое образование действующих синаптических связей между аксонами мотонейронов и мышечными клетками. (А, В) Фазово-контрастные фотографии растущих нервных отростков (N) и веретеновидных миоцитов (М) в нервно-мышечной культуре клеток Xenopus в начале (А) и в конце (В) электрической регистрации. (С, D) Whole-cell patch-clamp миоцитов. Можно зарегистрировать спонтанные синаптические токи уже через Î минуту после контакта (С), которые увеличиваются на несколько порядков к 18-й минуте (D). |
|
Изменения также происходят в терминали аксона, приводя в течение нескольких недель к образованию активных зон. Эти и многие другие исследования показывают, что образование синапса не является простым событием по принципу «все или ничего». Хотя функциональная синаптическая передача может устанавливаться довольно быстро, дифференцировка пре- и постсинаптических характерных свойств — более долгий процесс, идущий на протяжении нескольких недель развития, и он основан на обмене разнообразными молекулярными сигналами между нервной терминалью и мышечным волокном. Детальные морфологические и физиологические эксперименты показывают, что конусы роста соприкасаются с поверхностью мышечной клетки в произвольном месте, игнорируя сушествуюшие кластеры рецепторов АХ, и быстро приводят к формированию новых агрегатов рецепторов (рис. 4.).
Таким образом, терминали аксона должны высвобождать некий сигнал, который индуцирует накопление рецепторов АХ на мышечной клетке. Этот сигнал является специфическим для холинергических нейронов; при прорастании нехолинергических нейронов в мышечные клетки они не вызывают изменений в распределении рецепторов АХ. Однако сигналом к этому не является сам АХ; накопление рецепторов АХ под терминалями аксона происходит в культурах клеток в присутствии кураре и бунгаротоксина, которые блокируют взаимодействие АХ с его рецепторами. В экспериментах, изначально предназначенных для идентификации сигналов, контролирующих регенерацию нервно-мышечного соединения , был идентифицирован белок, названный агрином, который высвобождался терминалями двигательного нерва и приводил к накоплению рецепторов АХ, холинэстеразы и других компонентов постсинаптического аппарата в синаптических областях.
Вызванная агрином синаптическая дифференцировка
Агрин существует в нескольких изоформах, которые возникают вследствие альтернативного сплайсинга одного гена. Мотонейроны, мышечные клетки и шванновские клетки экспрессируют агрин, но только у мотонейронов агрин находится в такой изоформе, которая способна вызывать постсинаптическую дифференцировку. Агрин является большой молекулой (heparan sulfate proteoglyсап), домены которой взаимодействуют с ламииином, белками, связывающими гепарин, дистрогликаном, гепарином и интегринами (рис. 5). Способность индуцировать образование постсинаптической специализации в основном зависит от С-концевого домена.
Ведущая роль агрина в формировании нервно-мышечного соединения наиболее очевидна у мышей, у которых при помощи гомологичной рекомбинации выключена экспрессия гена агрина. При таком выключении гена мышечные волокна выглядят нормально и аксон растет в направлении развивающихся мышц, однако нервно-мышечные соединения не образуются.
|
|
Рис. 4. Аксоны вызывают агрегацию рецепторов ацетилхолина в областях контакта с мышечными клетками. Фазово контрастные (A. В) и флуоресцентные (С, D) микрофотографии нервно-мышечной культуры клеток Xenopus. Рецепторы ацетилхолина окрашены при помощи родамин бунгаротоксина. (А, С) До и сразу после контакта на миоците имеются спонтанно образованные кластеры рецепторов АХ. (В, D) Через 24 ч спонтанно образовавшиеся области рецепторов АХ исчезли и образовались новые области непосредственно в области аксонального контакта. |
Подобный же фенотип наблюдается у мышей, у которых выключен синтез мышечно-специфического рецептора тирозинкиназы MuSK. Это наводит на мысль, что MuSK формирует часть рецептора к агрину и что вызванное агрином аутофосфорилирование MuSK запускает внутриклеточный сигнальный каскад, который приводит к формированию необходимых компонентов в постсинапсе (рис. 6). Одним из наиболее важных компонентов является рапсин (rapsyn), белок, который, как считается, играет роль в передаче сигналов между рецепторами АХ, MuSK, дистрогликанами и членами Src семейства цитоплазматических рецепторов тирозинкиназ. Таким образом, в нервно-мышечном соединении мутантных мышей с дефицитом рапсина происходит накопление MuSK и выборочная экспрессия гена рецептора АХ в ядре, а также формируются некоторые характерные для синапса свойства, однако не происходит накопления рецепторов АХ.
|
Рис. 5. Агрин представляет собой гепаран-сульфат протеогликана большой массы (400-600 кДа). Его домены взаимодействуют с ламинином, гепаран сульфат протеогликанами (HSPGs), гепарином, дистрогликаном, интегрином, гепаринсвязывающими белками и рецепторами агрина, которые вызывают агрегацию рецепторов АХ. (А) Электронная микрофотография агрина после rotatory shadowing. (В) Схематическая диаграмма структурных и связывающихся доменов агрина цыпленка. EG — домен, подобный эпидермальному фактору роста; FS — домен, подобный фолиостатину; LE — домен, подобный ламинину EGF; LG — домен, подобный ламинину G; SEA — последовательность, обнаруженная в белках спермы морского ежа, энтерокиназах и агрине; S/T — домены, богатые серином и/или треонином. Также показаны области связывания. Глобулярные (1, 3-5) и вытянутые (2) области молекулы можно увидеть в части А. |
|