Страница
3
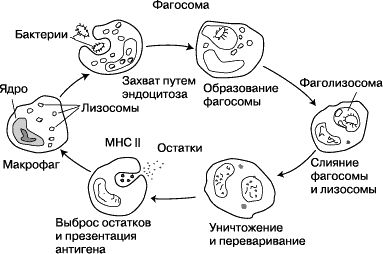
После поглощения чужеродного микроорганизма фагоцитом он оказывается в ловушке внутриклеточного пузырька, который называется фагосомой. Фагосома сливается с другим пузырьком - лизосомой, в результате чего формируется фаголизосома. Микроорганизм погибает под воздействием пищеварительных ферментов, либо в результате дыхательного взрыва, при котором в фаголизосому высвобождаются свободные радикалы. Фагоцитоз эволюционировал из способа получения захвата питательных веществ, но эта роль у фагоцитов была расширена, став защитным механизмом, направленным на разрушение патогенных возбудителей. Фагоцитоз, вероятно, представляет собой наиболее старую форму защиты макроорганизма, поскольку фагоциты обнаруживаются как у позвоночных, так и у беспозвоночных животных.
К фагоцитам относятся такие клетки, как мононуклеарные фагоциты (в частности - моноциты и макрофаги), дендритные клетки и нейтрофилы. Фагоциты способны связывать микроорганизмы и антигены на своей поверхности, а затем поглощать и уничтожать их. Эта функция основана на простых механизмах распознавания, позволяющих связывать самые разнообразные микробные продукты, и относится к проявлениям врождённого иммунитета. С появлением специфического иммунного ответа мононуклеарные фагоциты играют важную роль в его механизмах путём представления антигенов T-лимфоцитам. Для эффективного уничтожения микробов фагоцитам требуется активация.
Нейтрофилы и макрофаги представляют собой фагоциты, которые путешествуют по организму в поисках проникших сквозь первичные барьеры чужеродных микроорганизмов. Нейтрофилы обычно обнаруживаются в крови и представляют собой наиболее многочисленную группу фагоцитов, обычно представляющую около 50% -60% общего количества циркулирующих лейкоцитов. Во время острой фазы воспаления, в частности, в результате бактериальной инфекции, нейтрофилы мигрируют к очагу воспаления. Этот процесс называется хемотаксисом. Они обычно являются первыми клетками, реагирующими на очаг инфекции. Макрофаги представляют собой клетки многоцелевого назначения, обитающие в тканях и производящие широкий спектр биохимических факторов, включая ферменты, белки системы комплемента и регуляторные факторы, например интерлейкин-1. Кроме того, макрофаги выполняют роль уборщиков, избавляя организм от изношенных клеток и другого мусора, а также роль антиген-презентирующих клеток, активирующих звенья приобретённого иммунитета. [4]
Дендритные клетки представляют собой фагоциты в тканях, которые соприкасаются с внешней средой, то есть, расположены они, главным образом, в коже, носу, лёгких, желудке и кишечнике. Они названы так, поскольку напоминают дендриты нейронов наличием многочисленных отростков, однако дендритные клетки никоим образом не связаны с нервной системой. Дендритные клетки служат связующим звеном между врождённым и приобретённым иммунитетом, поскольку они представляют антиген T-клеткам, одному из ключевых типов клеток приобретённого иммунитета.
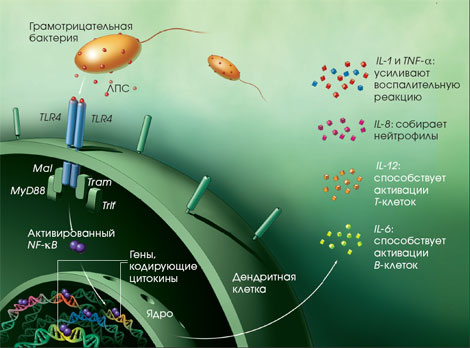
Бактерицидная активность фагоцитов
Еще в 1908 г. русский ученый И.И. Мечников открыл не только прямые бактерицидные свойства микрофагов-нейтрофилов и макрофагов, но и также предполагал другие возможные их функции, как, например, передача иммунитета…посредствам белых корпускул через продукцию "секретинов". Нейтрофилы являются короткоживущими, но чрезвычайно многочисленными, и им была отведена фундаментальная роль в разрушении внеклеточных патогенов и их токсинов, тогда как другая группа фагоцитов, производных от моноцитов-макрофаги, относятся к длительноживущим клеткам. В дополнение к бактерицидной активности фагоциты способны осуществлять ряд других важных функций, таких как: ограничение роста облигатных внутриклеточных патогенов, продукция многих биоактивных молекул, необходимых для регуляции различных функций клеток (компоненты комплемента, простагландины и цитокины), удаление дефектных клеток.
Первичный ответ на внедрение микробного патогена в организм осуществляется резидентными макрофагами, которые продуцируют факторы воспаления и изменяют хемотаксический градиент. В свою очередь, нейтрофилы отвечают на межклеточные сигналы и проходят через эпителий, при этом их слабая адгезия опосредована - селектинами. Эти фагоциты уже активизированы для адгезии к эндотелию посредством собственных мембранных интегринов и способны распознавать специальными рецепторами - серпентинами - специфические хемоаттрактанты. Одновременно с этим происходит изменение формы клетки посредством перегруппировки активного цитоскелета. Нейтрофилы продолжают получать информацию, которая в дальнейшем изменяет их ответную реакцию.
Известны два отчетливо различимых функциональных состояния фагоцитов "redox", с низким уровнем протекания процессов, и активированное, который обусловлен взаимодействием клеток с различными стимуляторами. При этом в процессе предварительного воздействия стимулов отмечается усиление миграции, адгезии, дегрануляции и метаболизма нейтрофилов и макрофагов. Это явление получило название прайминга, то есть подготовки, перевода клеток в рабочее состояние. Таким образом, нейтрофилы, достигнув места воспаления, способны распознать патоген либо непосредственно через мембранные рецепторы для опсонинов, либо через лектины микробов и фагоцитов. В дальнейшем начинается процесс фагоцитоза, осуществляемый с помощью механизма, действующего как замок молния. Происходит поглощение микробов посредством инвагинации плазматической мембраны клеток и образование фагоцитарной вакуоли. При этом параллельно активируется две функции фагоцитов: выброс содержимого гранул в фагосому и кислородный взрыв.
Феномен кислородного взрыва впервые был описан в 1933 г., его суть состоит в том, что фагоциты резко увеличивают потребление кислорода - от 50 до 100 раз. Этот процесс происходит при стимуляции комплекса НАДФ - оксидазы, также известной как фагоцитарная оксидаза, или оксидаза кислородного взрыва. Субклеточная локализация этого комплекса хорошо изучена в нейтрофилах. В макрофагах этот комплекс выявляется только на плазматической мембране. Ввиду того, что составляющие этого комплекса, не обнаружены на мембранах гранул макрофагов - эти клетки не способны продуцировать реактивные виды кислорода внутрифагосомально.
На первом этапе для образования из молекулы кислорода супероксидного аниона О2 - донором электронов является НАДФ - оксидазный комплекс. Этот комплекс включает 4 белковых компонента, молекулярные массы, которых вошли в их название - Р40 PHOX (PHOX расшифровывается как фагоцитарная оксидаза. В клетках состояния покоя - “redox” - три этих компонентов - P40 PHOX,P47 PHOX и P67 PHOX находятся в цитозоле в виде комплекса, а два других компонента - P22 PHOX и gp91 PHOX локализованы на плазматической мембране или на мембране секреторных везикул и азурофильных гранул, где они представлены в виде гетеродимерных флавогемопротеинов, известных как цитохром b558. При стимуляции клеток цитозольный компонент р67 PHOX фосфорилируется и выступает в качестве адаптера связи компонента р67 PHOX с цитохрома b558, а в свою очередь, фосфорилирование р40 PHOX вызывает конформационные изменения р67 PHOX для его полноценной связи с цитохромом [9]. Таким образом, собранный НАДФ - оксидазный комплекс способен передаче электронов от субстрата к кислороду посредством собственных электрон-несущих протеазных групп - флавинов, преобразуясь при этом в так называемый восстановленный НАДФ+ - комплекс. В процессе сборки НАДФ-комплекса участвуют также низкомолекулярные белки, связанные с нуклеотидом гуаназин 5’ - трифосфатом - Rac. В процессе активации фагоцита Rac1/2 связываются с гуаназин фосфатом (ГТФ) и мигрируют к плазматической мембране вместе с основным цитозольным комплексом. В это же время цитохром b558 и Rap 1А доставляются к клеточной поверхности посредством слияния мембран, таким образом, локализуя НАДФ - оксидазный комплекс внутри фагосомы. Это позволяет эффективно доставлять активные метаболиты кислорода для уничтожения поглощенной мишени. Отмечаются различные пути регуляции НАДФ - оксидазы нейтрофилов в зависимости от того, где она локализована на плазматической мембране или на мембране гранул. Активация НАДФ - оксидазы, локализованы на плазматической мембране регулируется сложным путем комплекса сигналов, опосредованных через мощный приток Са2+. В моноцитах/макрофагах в процессе фосфорилирования принимает участие фермент - протеиновая киназа.
