Страница
2
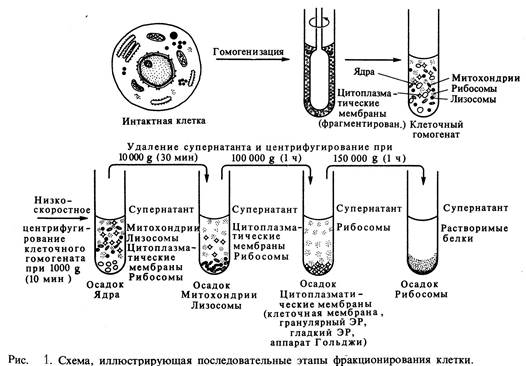
Сравнительно недавно был создан другой метод фракционирования клеток – центрифугирование в градиенте плотности; при этом центрифугирование производят в пробирке, в которой предварительно наслаивают друг на друга растворы сахарозы все возрастающей концентрации, а следовательно, и возрастающей плотности. При центрифугировании содержащиеся в гомогенате органеллы располагаются в центрифужной пробирке на тех уровнях, на которых находятся растворы сахарозы, соответствующие им по плотности. Этот метод дает биохимикам возможность разделять органеллы одинаковых размеров, но разной плотности (рис. 1.).
Радиоавтография – сравнительно новый метод, безмерно расширивший возможности как световой, так и электронной микроскопии. Это в высшей степени современный метод, обязанный своим возникновением развитию ядерной физики, которое сделало возможным получение радиоактивных изотопов различных элементов. Для радиоавтографии необходимы, в частности, изотопы тех элементов, которые используются клеткой или могут связываться с веществами, используемыми клеткой, и которые можно вводить животным или добавлять к культурам в количествах, не нарушающих нормального клеточного метаболизма. Поскольку радиоактивный изотоп (или помеченное им вещество) участвует в биохимических реакциях так же, как его нерадиоактивный аналог, и в то же время испускает излучение, путь изотопов в организме можно проследить с помощью различных методов обнаружения радиоактивности. Один из способов обнаружения радиоактивности основан на ее способности действовать на фотопленку подобно свету; но радиоактивное излучение проникает сквозь черную бумагу, используемую для того, чтобы защитить фотопленку от света, и оказывает на пленку такое же действие, как свет.
Чтобы на препаратах, предназначенных для изучения с помощью светового или электронного микроскопов, можно было обнаружить излучение, испускаемое радиоактивными изотопами, препараты покрывают в темном помещении особой фотоэмульсией, после чего оставляют на некоторое время в темноте. Затем препараты проявляют (тоже в темноте) и фиксируют. Участки препарата, содержащие радиоактивные изотопы, воздействуют на лежащую над ними эмульсию, в которой под действием испускаемого излучения возникают темные «зерна». Таким образом, получают радиоавтографы (от греч. радио – лучевидный, аутос – сам и графо – писать).
Вначале гистологи располагали лишь несколькими радиоактивными изотопами; так, например, во многих ранних исследованиях с применением радиоавтографии использовался радиоактивный фосфор. Позднее стали использовать значительно больше таких изотопов; особенно широкое применение нашел радиоактивный изотоп водорода – тритий.
Радиоавтография имела и имеет до сих пор очень широкое применение для изучения того, где и как в организме протекают те или иные биохимические реакции.
Химические соединения, меченые радиоактивными изотопами, которые используются для исследования биологических процессов, называют предшественниками. Предшественники – это обычно вещества, подобные тем, которые организм получает из пищи; они служат строительными блоками для построения тканей и включаются в сложные компоненты клеток и тканей таким же образом, как в них включаются немеченые строительные блоки. Компонент ткани, в который включается меченый предшественник и который испускает излучение, называется продуктом.
Клетки, выращиваемые в культуре, хотя и принадлежат к одному и тому же типу, в любой данный момент времени будут находиться на разных стадиях клеточного цикла, если не принять специальных мер для синхронизации их циклов. Тем не менее, путем введения в клетки тритий-тимидина и последующего изготовления радиоавтографов можно определить продолжительность различных стадий цикла. Время наступления одной стадии – митоза – можно определить и без меченого тимидина. Для этого выборку клеток из культуры держат под наблюдением в фазово-контрастном микроскопе, который дает возможность непосредственно следить за течением митоза и устанавливать его сроки. Продолжительность митоза обычно равна 1 ч, хотя в клетках некоторых типов он занимает до 1.5 ч.
Определение продолжительности G 2-периода.
Для определения продолжительности G 2–периода применяют метод, известный под названием импульсной метки: к культуре клеток добавляют меченый тимидин, а спустя короткое время заменяют культуральную среду свежей, с тем, чтобы предотвратить дальнейшее поглощение клетками меченого тимидина. При этом метку включают только в те клетки, которые в течение кратковременного пребывания в среде с тритий-тимидином находились в S-периоде клеточного цикла. Доля таких клеток невелика и лишь небольшая часть клеток получит метку. Кроме того, все клетки, включающие метку, будут находиться в интерфазе – от клеток, едва вступивших в S-период, до таких, которые почти закончили его за время воздействия тритий-тимидина. В пробе, взятой сразу после удаления меченого тимидина, метка содержится только в интерфазных ядрах, принадлежащих клеткам, которые в период воздействия метки находились в S-периоде; те же клетки, которые в этот период находились в состоянии митоза, остаются немечеными.
Если затем продолжать отбирать из культуры пробы через определенные промежутки времени и изготовлять для каждой последовательной пробы радиоавтограф, то наступит момент, когда метка начнет появляться в митотических d-хромосомах. Метки будут включаться во все те клетки, которые в период наличия в среде тритий-тимидина находились в S-периоде, причем среди этих клеток будут как только что вступившие в S-период, так и почти закончившие его. Совершенно очевидно, что эти последние первыми среди меченых клеток проделают митоз и, следовательно, в их митотических хромосомах обнаружится метка. Тем самым промежуток между 1) временем, когда из культуры был удален меченый тимидин, и 2) временем появления меченых митотических хромосом будет соответствовать продолжительности G 2–периода клеточного цикла.
Определение продолжительности S-периода.
Поскольку клетки, находящиеся в момент введения в среду метки в самом конце S-периода, первыми вступят в митоз, то, следовательно, в тех клетках, у которых S-период начинается непосредственно перед удалением метки, меченые митотические хромосомы появятся в последнюю очередь. Поэтому, если бы нам удалось определить промежуток между временем вступления в митоз клеток, помеченных первыми, и клеток, помеченных последними, мы установили бы продолжительность S-периода. Однако, хотя время, когда впервые появляются меченые митотические хромосомы, установить легко, время вступления в митоз клеток, помеченных последними, определить невозможно (этому препятствует очень большое количество меченых делящихся клеток в последних пробах). Поэтому продолжительность S-периода приходится определять другим способом.
При исследовании радиоавтографов последовательных проб клеток, отбираемых через одинаковые промежутки времени, обнаруживается, что доля клеток, несущих метку в своих митотических хромосомах, постепенно возрастает, пока мечеными не окажутся буквально все делящиеся клетки. Однако, по мере того как клетки одна за другой завершают митоз, они превращаются в меченые интерфазные клетки. Первыми завершают митоз те из меченых клеток, которые вступили в него первыми; и соответственно из клеток с мечеными митотическими хромосомами последними завершают митоз те, которые вступили в него позже всех. Поскольку продолжительность митоза всегда одинакова, то, следовательно, если бы мы могли определить промежуток между: 1) временем окончания митоза в клетках, включивших метку первыми, и 2) временем окончания митоза в клетках, включивших метку последними, мы установили бы продолжительность S-периода. Продолжительность S-периода нетрудно установить, определив промежуток между: 1) моментом времени, когда 50% митотических клеток в культуре несут метку, и 2) моментом времени, после которого культура уже не содержит 50% меченых клеток.
