Мембранные белки
![]()
ОцеНИВ Квело* и взяв детергент из таблиц, получают молекулярную массу белковой составляющей м,.
Для построения графика зависимости 5° от q проводят аналитическое центрифугирование. Можно проводить центрифугирование и в градиенте плотности сахарозы, используя смеси Н2О и D2O, но анализ результатов в этом случае гораздо сложнее, хотя принципиально не отличается от предыдущего случая.
Альтернативный способ определения молекулярной массы нативной формы мембранного белка состоит в равновесном ультрацентрифугировании. Распределение вещества в состоянии равновесия таково, что наклон графика зависимости логарифма концентрации от г2 равен
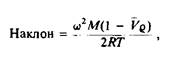
где г — расстояние от центра ротора до данной точки в центрифужной пробирке, W — частота вращения.
Если величина У известна или ее легко оценить, как для большинства растворимых белков, эта задача решается достаточно просто. Что касается мембранных белков, то в этом случае определяют на-
Таблица 3. Связывание детергентов с некоторыми мембранными белками
|
Белок Na + /К * -АТРаза |
Детергент Тритон Х-100 |
Количество связанного детергента, мг на 1 мг белка 0,28 |
Ссылки |
|
Са2 + -АТРаза |
Тритон Х-100 |
0,20 | |
|
Белок полосы 3 |
Тритон Х-100 |
0,77 | |
|
Ацетилхолиновый |
Тритон Х-100 |
0,70 | |
|
рецептор | |||
|
Родопсин |
Тритон Х-100 |
1,10 | |
|
Переносчик |
Тритои Х-100 |
1,5 | |
|
ADP/ATP | |||
|
Инсулииовый |
Тритон Х-100 |
0,15; 0,31; 0,54 | |
|
рецептор | |||
|
Инсулииовый |
Дезоксихолат |
0,01; 0,03 | |
|
рецептор | |||
|
Цитохром |
Тритон Х-100 |
0,6 | |
|
с-оксидаза | |||
|
Цитохром |
Лаурилмальтозид |
0,55 |
клон указанной прямой при разных значениях q, получаемых смешиванием НгО и D2O. Как и ранее, одновременно находят Мк и К, и далее определяют молекулярную массу белка.
Если в комплексе присутствует третий компонент, возникают дополнительные проблемы. В любом случае все описанные процедуры весьма сложны и могут давать ошибочные результаты. Количество детергента, связанного с очищенными интегральными мембранными белками, может быть весьма существенным — от 0,3 до 1,5 от массы белка, и даже небольшие ошибки в этой величине приведут к значительному искажению молекулярной массы белка. В табл. 3.3 приведены данные о количестве детергентов, присутствующих в некоторых белковых препаратах. Заметим, что растворимые белки с этими детергентами не связываются; это опять свидетельствует о том, что за связывание с детергентом ответственна именно неполярная часть белка, обычно контактирующая с мембранными липидами.
3.3 МЕТОД РАДИАЦИОННОЙ ИНАКТИВАЦИИ
Метод радиационной инактивации для определения размера мишени все чаще применяется при исследовании мембранных белков. Изучать можно как очищенные белки, так и неочищенные препараты, в том числе интактные биомембраны. Суть метода состоит в определении доли белковых молекул, получающих повреждения при облучении. Для этого используют ферментативные методы связывания гормонов или других лигандов или спектральные методы. Процедура состоит в следующем. Образец, обычно замороженный, подвергают высокоэнергетическому облучению. Через разные промежутки времени отбирают пробы, размораживают их и проводят измерения. Повреждения белка под действием излучения выявляют, например, с помощью электрофореза в ПААГ с ДСН. Как показывает опыт, некоторые субъединицы полностью утрачивают биологическую активность при внесении радиационного повреждения в любое место полипептидной цепи. Ключевым моментом является то, что, чем крупнее белковая молекула, тем больше вероятность ее повреждения и, следовательно, вероятность инактивации. Эта вероятность зависит не от формы молекулы, а от ее массы. Обычно для того, чтобы облегчить интерпретацию результатов, параллельно облучают белок с известной молекулярной массой. Если исследуемый белок содержит более одной субъединицы, возникают определенные трудности при анализе результатов. Повреждение одной субъединицы не обязательно сопровождается разрывом ковалентных связей в других субъединицах. Поэтому для ферментов, состоящих из разных субъединиц, обладающих неодинаковыми активностями, могут быть получены разные размеры мишени в зависимости от метода определения степени инактивации.
Примечательной особенностью метода является то, что его можно использовать для изучения интегральных мембранных белков in situ. Возникающие при этом артефакты и проблемы рассмотрены в работе. Одна из очевидных проблем — необходимость использования высокоэнергетического излучения. В связи с этим большинство работ приходится проводить в сотрудничестве с лабораториями, в которых имеются соответствующие источники и освоены специальные методы анализа.
