Страница
5
С проблемой гетерогенности тесно связано явление фенокопий. О фенокопии говорят, когда негенетическая причина сказывается на проявлении фенотипа, характерного для наследственного заболевания. К примеру, гомозиготность по мутантному аллелю гена i-антитрипсина часто вызывает легочную эмфизему, но более частой причиной такого фенотипа в общей популяции является курение.
Фенокопии сказываются на анализе сцепления таким же образом, как и гетерогенность: наряду с семьями, в которых выявляется сцепление с маркером, обнаруживаются семьи, в которых расщепление затрагивает разные локусы. В случае независимости возникновения фенокопии в общей популяции можно повысить генетическую информативность семей, введя требование о большем количестве содержащихся в них больных индивидов. Так, генетическая этиология более вероятна для семьи, где пять близких родственников болеют раком молочной железы, нежели для семьи, где больных всего двое. Однако этот аргумент теряет значение, если фенокопии появляются в семейных кластерах, к примеру, вследствие сходных условий проживания. В этом случае необходимо попытаться собрать однородную выборку семей, в которых сегрегирует генетическая ферма этого заболевания, и анализировать ее на основе стратегии, описанной выше для генетической гетерогенности. Если предполагаются и генетическая гетерогенность, и фенокопии, симультанный скрининг может быть модифицирован с учетом коррекции на долю «несцепленных» семей.
В любом случае слишком большая доля фенокопии в выборке значительно затруднит всякую попытку найти сцепление.
6. Осложнения: генетические взаимодействия
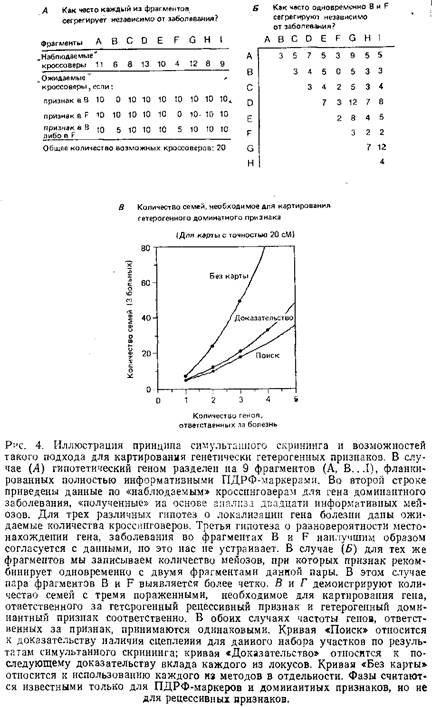
Некоторые признаки являются результатом генетического взаимодействия аллелей более чем одного локуса. Среди низших организмов это подтверждается множеством фактов, чего не скажешь о человеке. К примеру, известно, что проявление талассемии частично подавляется наличием fi-формы. Предполагается также, что по крайней мере некоторые из заболеваний, демонстрирующие частичную ассоциацию с генотипом HLA, могут быть обусловлены также и другими локусами.
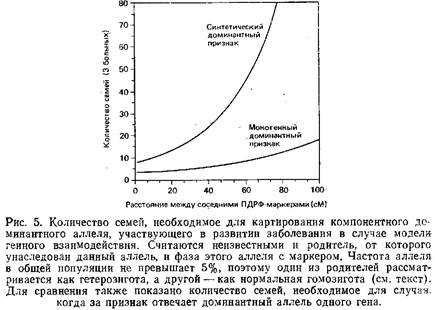
Результатом генетического взаимодействия является и так называемый синтетический признак. Такой признак обусловлен несколькими «взаимодействующими» локусами, т.е. проявляется только при наличии соответствующих аллелей по всем вовлеченным локусам, в противном случае развивается абсолютно нормальный фенотип. По некоторым локусам мутантные аллели могут доминировать, по другим – быть рецессивными. Часть аллелей может встречаться редко, в то время как другие обнаруживаются в популяции с высокой частотой. Распространенность такого признака будет отражать произведение частот мутаций по всем локусам, участвующим в его детерминации.
Одна из возможных проблем при картировании локусов, вовлеченных во взаимодействие, заключается в том, что некоторые родители могут быть гомозиготными па одному из компонентных локусов, хотя и не будут проявлять интересующий признак из-за отсутствия нужного генотипа по другим локусам. Так как больной ребенок мог унаследовать любую из хромосом такого родителя, то для данной семьи не удастся установить сцепление с определенным локусом. Анализ такого заболевания позволяет утверждать, что картина похожа на случай, когда в выборке имеется большая доля семей с негенетической природой заболевания.
Однако проблема гомозиготности родителей становится значительной только при достаточно высокой частоте соответствующего аллеля по данному локусу. По существу, успешно могут быть картированы только те компонентные локусы, в которых аллели, обусловливающие заболевание, встречаются с низкой частотой.
Иногда следует учитывать параметры, минимизирующие эффект гомозиготности родителей. К примеру, изучение семей с очень большой долей пораженных сибсов может быть нежелательным: в такой семье более вероятно, что один или оба родителя гомозиготны по одному или более компонентным локусам.
Кроме проблемы гомозиготности родителей существует еще одно осложнение при картировании генетического взаимодействия: здоровые дети значительно затрудняют любую попытку картировать отдельный компонентный локус. Если ребенок и наследует по какому-то локусу аллель, ответственный за заболевание, он может не унаследовать саму болезнь, если не унаследует всех необходимых для данного заболевания аллелей по другим локусам. Таким образом, как было отмечено выше, генотипы здоровых детей не могут рассматриваться как свидетельство против сцепления с возможным локусом; полагаться стоит только на генотипы больных детей.
Если предположить, что больные дети являются следствием исключительно генетических причин и что частота аллелей невелика, то анализ сцепления становится относительно простым.
1. Для рецессивного компонентного локуса картирование происходит как и в моногенном случае: признак будет сегрегировать совместно с каждым из рецессивных компонентных локусов; требуется такое же количество семей с заданным числом больных индивидов.
2. Для доминантного компонентного локуса единственное отличие от моногенного случая заключается в том, что нельзя сказать, какой из двух родителей привносит аллель, ответственный за болезнь. Вследствие этого необходимо количество семей большее, чем для случая простого моногенного наследования.
7. Полигенное наследование
Известно, что наследование некоторых признаков характеризуется такими генетическими феноменами, как гетерогенность, неполная пенетрантность или интегрирующее взаимодействие. Наиболее сложное наследование – полигенное, при котором аллели нескольких разных локусов взаимодействуют друг с другом по принципу аддитивности, обусловливая таким образом риск проявления признака или заболевания. Каждый добавочный «плохой» аллель увеличивает предрасположенность индивида, но ни один из локусов не является существенным для этиологии данного заболевания. Поэтому в данном случае невозможно по фенотипу определить генотип. Расчеты показывают, что картирование полигенных заболеваний в общей популяции людей бесперспективно. Тем не менее, для поиска полигенных факторов при скрещивании линий животных, отличающихся по физиологическим признакам, были разработаны методы, использующие весь потенциал полной карты ПДРФ-маркеров. Подобные исследования могут выявить специфические локусы, которые в дальнейшем следует изучать более прямыми методами у человека.
8. Картирование редких рецессивных признаков
В случае многих заболеваний трудно подобрать достаточное количество семей с несколькими больными индивидами для проведения традиционного анализа сцепления. Многие рецессивные нарушения, имеющие медицинскую или биологическую значимость, очень редки и возникают случайно у отдельных индивидов или в малых группах. Даже для распространенных заболеваний подбор семей с несколькими больными может быть сложной задачей, если болезнь приводит к гибели в раннем возрасте.
Недавно для картирования редких рецессивных заболеваний был описан эффективный подход, названный картированием по гомозиготности. При этом используется ДНК больных детей от близкородственных браков. В 1902 году Гэррод заметил, что значительную часть его больных алкаптонурией составляли дети от браков между родственниками. Почти сразу же Бэтсон предложил объяснение, основанное на законах Менделя и состоявшее в том, что близкородственные браки предоставляют наилучшую возможность для рецессивного аллеля перейти в гомозиготное состояние. Действительно, чем реже болезнь, тем большей будет доля инбредных браков среди родителей больных детей: если частота аллеля, ответственного за данное заболевание в данной популяции, есть q, то вероятность его гомозиготности в целой популяции пропорциональна q2, но пропорциональна q в инбредной популяции. Значительная область хромосомы, фланкирующая предполагаемый локус заболевания, также переходит в гомозиготное состояние «по происхождению». Для ребенка от брака двоюродных родственников среднестатистический размер этой области гомозиготности «по происхождению» достигает приблизительно 28 см. Отсюда следует стратегия поиска локуса, ответственного за болезнь: необходимо найти область, неизменно гомозиготную «по происхождению», у больных детей от близкородственного брака.
