Борорганические соединения
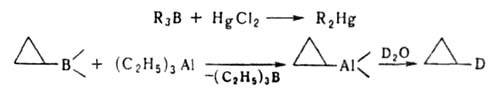
Только с использованием соответствующих борорганических соединений получены органические производные Ag и Си, напр. 1-(2-хлорферроценил)серебро, циклопентадиенилмарганецтрикарбонилмедь.
Обменные р-ции органоборанов (диспропорционирование и симметризация) катализируются соед., содержащими группу В—Н, напр.:
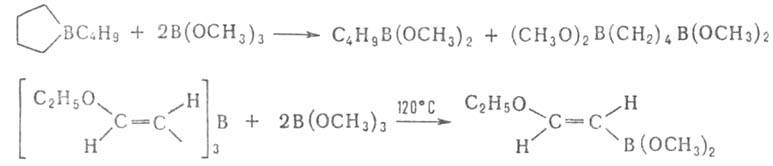
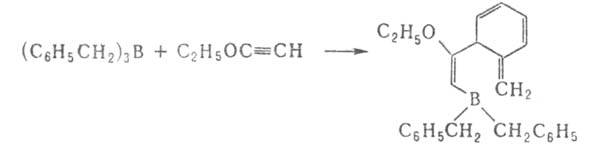
Присоединение к кратным связям не характерно для борорганических соединений. Известно лишь неск. примеров таких р-ций, напр. присоединение трибензилборана к алкоксиацетиленам (протекает с перегруппировкой):
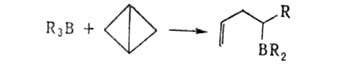
При р-циях Alk3B с циклопропенами и бициклобутаном образуются непредельные борорганические соединения:
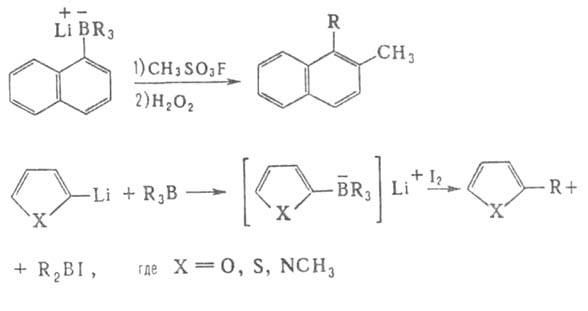
3. 1, 2-Анионотропные перегруппировки приводят к образованию новых связей С—С, С—О, С—S, С—N и т.д.:
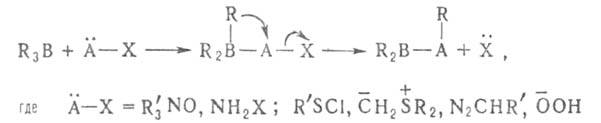
Во всех случаях сохраняется конфигурация R.
К этому типу р-ций относится взаимодействие органоборанов с аминоксидами, алкилсульфенилгалогенидами, илидами, Н2О2, диазосоединениями, а также перегруппировки органоборанов, содержащих электроотрицательные группы у атома С в![]() положении к В, под действием нуклеофилов (R"OH, R"NH2) или электрофилов (А1С13, ZnCl2):
положении к В, под действием нуклеофилов (R"OH, R"NH2) или электрофилов (А1С13, ZnCl2):
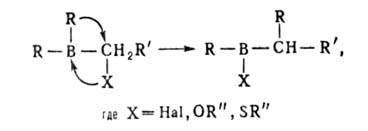
При взаимод. органоборанов R3B и борацикланов с СО (карбонилирование) мигрируют в зависимости от т-ры одна, две или три группы R:
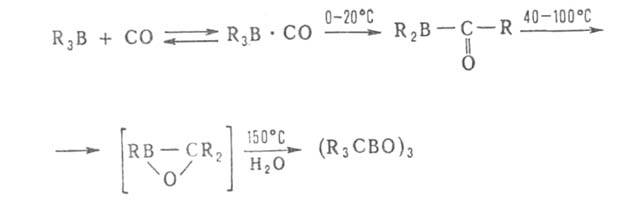
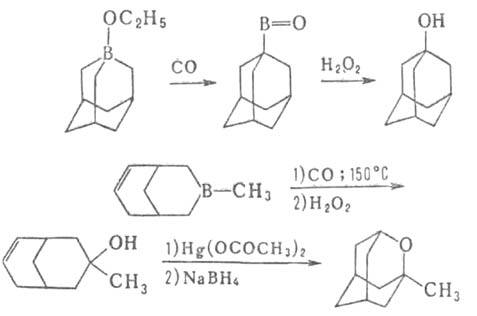
Карбонилирование применяется для синтеза спиртов, альдегидов, карбоновых к-т, в т.ч. прир. в-в, напр. ювабиона, а также циклич. и каркасных соед., напр.:
Мн. органобораты устойчивы в обычных условиях, но перегруппировываются под действием электроф. реагентов Е—У по схеме:
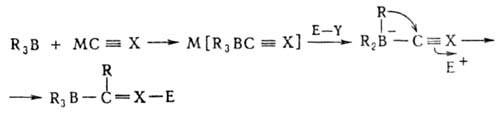
где МС![]() Х = МС
Х = МС![]() CR', MC
CR', MC![]() N, MCH=CR2', MAr; М = = Li, Na, К; Е—Y = НС1, СH3I, (CH3)2SO4, (C2H5)3OBF4, CH2=CHCH2Br, CH3COC1 и др.
N, MCH=CR2', MAr; М = = Li, Na, К; Е—Y = НС1, СH3I, (CH3)2SO4, (C2H5)3OBF4, CH2=CHCH2Br, CH3COC1 и др.
Примеры - получение замещенных кетонов и дизамещенных ацетиленов, диалкилирование ароматических соед., ![]() алкилирование тиофена, N-метилиндолов и фурана, напр.:
алкилирование тиофена, N-метилиндолов и фурана, напр.:
Р-ция R3B с изонитрилами приводит к 2, 5-диборадигидропиразинам (при 150°С), к-рые при нагр. до 200°С (или в присут. протонных р-рителей) изомеризуются в 2, 5-диборапиперазины, что применяется для получения кетонов и третичных спиртов.
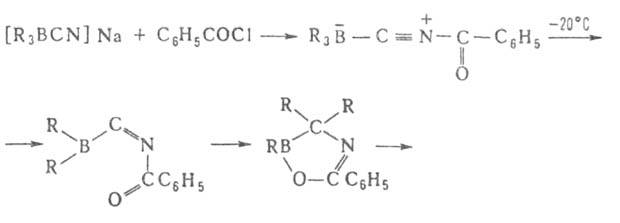
Триорганоцианобораты [R3BCN]-Na+, образующиеся при взаимодействии R3B и NaCN в воде или диглиме, устойчивы в обычных условиях, но перегруппировываются под действием HCN, (CF3CO)2O и С6Н5СОС1. Из образующихся при этом 1-окса-4-аза-2-борациклоент-4-енов получают амины, кетоны или третичные спирты:
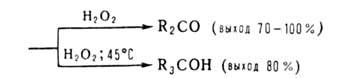
4. Радикальные р-ции, первая стадия к-рых - гомолитич. разрыв связи В—С Включают: автоокисление (применяется в синтезе пероксидов, спиртов, гидропероксидов, полимеров); сдваивание радикалов под действием солей Ag, Cu, Au, Pt, Pd (при получении углеводородов и их производных, металлоорганич. соед.); инициируемое О2, УФ-излучением или пероксидами 1, 4-присоединение R3B к![]() непредельным альдегидам и кетонам; деалкилирование триалкилборанов меркаптанами, диалкилдисульфидами; алкилирование нек-рых олефинов, ароматич. и гетероциклич. соед.:
непредельным альдегидам и кетонам; деалкилирование триалкилборанов меркаптанами, диалкилдисульфидами; алкилирование нек-рых олефинов, ароматич. и гетероциклич. соед.:
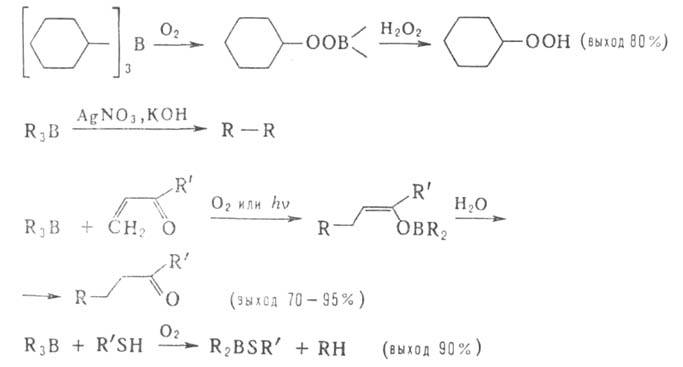
Эфиры акриловой и метакриловой к-т, их нитрилы и др. мономеры полимеризуются под действием органоборанов и следов О2 по цепному радикальному механизму.
5. Р-ции с участием![]() Н и
Н и![]() Н, т.е. атомов Н соотв. в
Н, т.е. атомов Н соотв. в![]() или
или![]() положении к атому В. При галогенировании алкилборанов замещается атом
положении к атому В. При галогенировании алкилборанов замещается атом![]() Н и образуются
Н и образуются![]() галогеналкилбораны. Последние расщепляются выделившимся HHal, давая RHal, а под действием Н2О, аминов или А1На13 перегруппировываются с образованием новой связи С—С, напр.:
галогеналкилбораны. Последние расщепляются выделившимся HHal, давая RHal, а под действием Н2О, аминов или А1На13 перегруппировываются с образованием новой связи С—С, напр.:
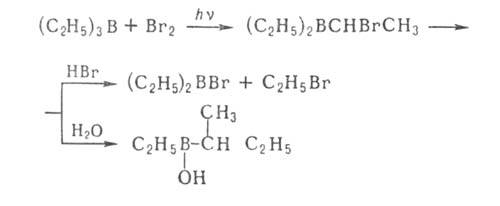
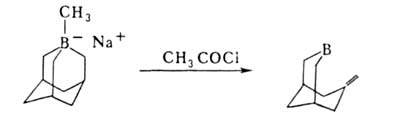
Отщепление![]() Н в виде гидрид-иона - основная стадия р-ций органоборатов с галогенсодержащими орг. соед. (С6Н5СН2С1, RCOC1 и др.):
Н в виде гидрид-иона - основная стадия р-ций органоборатов с галогенсодержащими орг. соед. (С6Н5СН2С1, RCOC1 и др.):
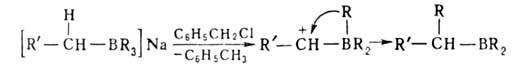
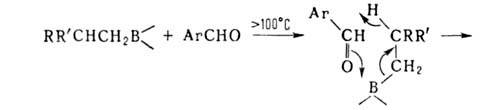
Р-ции алкил- и циклоалкилборанов с участием![]() Н: переалкилирование высшими олефинами, диенами, ацетиленами, восстановление нитрилов, ароматич. альдегидов и т.д., напр.:
Н: переалкилирование высшими олефинами, диенами, ацетиленами, восстановление нитрилов, ароматич. альдегидов и т.д., напр.:
![]()
Отрыв![]() лежит в основе синтеза олефинов из нек-рых органоборатов:
лежит в основе синтеза олефинов из нек-рых органоборатов:
Борорганические соединения, содержащие электроотрицат. группы X (Hal, OR, SR) в![]() или
или![]() положениях к атому В, легко претерпевают элиминирование:
положениях к атому В, легко претерпевают элиминирование:
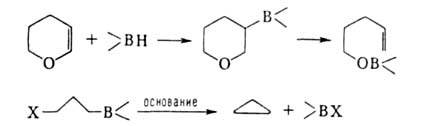
6. Термич. изомеризация, т.е. миграция В в конец углеродной цепи - уникальное св-во алкил- и циклоалкилборанов:
