Страница
2
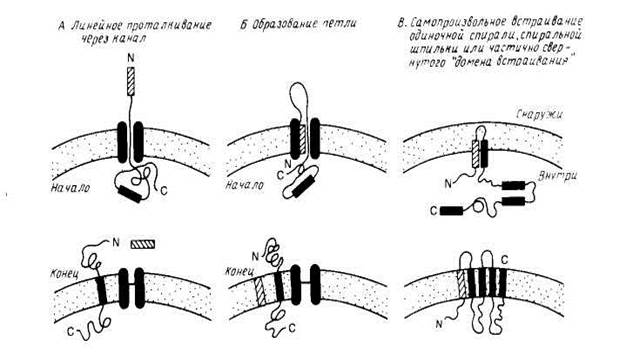
Рис2. Модели встраивания белка
Экспериментальные данные, которые однозначно свидетельствовали бы о существовании каналов, участвующих в сборке мембранных белков или в переносе белков через мембрану, отсутствуют. Известно, впрочем, что как на поверхности митохондрий, так и в эндоплазматическом ретикулуме имеются мембранные рецепторы, которые специфически узнают переносимые белки, и, возможно, именно они являются частью сложного аппарата, куда входит и канал, по которому перемещается белок.
Для того, чтобы перенос белков происходил со скоростью, близкой к скорости синтеза полипептида (1—10 остатков в 1 с), энергетический барьер не должен превышать примерно 18 ккал/моль. По полученным данным , две соседние спирали могут спонтанно встраиваться в бислой с образованием спиральной шпильки, и соответствующий выигрыш свободной энергии ~ 60 ккал/моль может стать движущей силой для частичного втягивания полярных и даже заряженных групп в липидный бислой. Однако, для переноса ионизированных и полярных групп из водного окружения в липидный бислой необходимо большее количество свободной энергии, н вряд ли модель спонтанного встраивания будет применима всегда, поскольку при сборке многих мембранных белков необходимо транспортировать через мембрану длинные, часто сильно заряженные полнпептидные цепи.
Тем не менее было показано, что некоторые небольшие мембранные белки включаются в лнпидные бислон спонтанно. К ним относятся цитохром bs с единственным гидрофобным якорем на С-конце и пробелок оболочки бактериофага М13, предположительно содержащий две трансмембранные спирали, которые, возможно, и встраиваются в бислой с образованием спиральной шпильки или петли. Пробелок оболочки содержит сигнальную последовательность из 23 остатков, обычно отщепляемую при сборке в цитоплазматической мембране Е. coli. Зрелый белок (50 аминокислотных остатков) имеет кислый N-конец, обращенный в периплазматическое пространство, трансмембранный сегмент и основный С-конец, обращенный в цитоплазму. Он спонтанно встраивается в фосфолипидные липосомы, причем скорость его сборки in vivo сильно замедляется, если в трансмембранном участке или на С-конце зрелого белка имеются мутации, что согласуется с моделью, в рамках которой два гидрофобных сегмента могут спонтанно встраиваться в липидный бислой в виде шпильки или петли. На рис. 3 представлена схема встраивания этого белка в мембрану. Интересно, что сборка пробелка оболочки вируса М13 может осуществляться и с помощью микросом млекопитающих, причем этот процесс требует АТР, возможно, для поддержания необходимой для транспорта конформации. Следует отметить, что этот белок не типичен для белков, сборка которых осуществляется на плазматической мембране Е. coli, поскольку он имеет отщепляемую сигнальную последовательность, и его сборка происходит независимо от функций генов secA, secY (prlA), необходимых для переноса белков внутрь плазматической мембраны или через нее.
Результаты исследования пробелка оболочки бактериофага М13 убедительно проиллюстрировали справедливость механизма самопроизвольного встраивания белков в мембрану без участия белков-посредников. Предполагается, что водорастворимый предшественник приобретает конформацию, обеспечивающую встраивание его в мембрану, при взаимодействии с бислоем. Эта обобщенная модель была предложена как часть «мембранной триггерной гипотезы». Необходимым условием нормального транспорта белка через мембрану является неполное его сворачивание в 3 и 4 структуры.

рис.3 модель самопроизвольного встраивания
2.1 Транспорт белков
Необходимо также рассмотреть механизмы с помощью которых белки доставляются к нужному месту. Есть несколько способов основным является экзоцитозный путь.
Экзоцитозным в эукариотических клетках называется путь, с помощью которого осуществляется транспорт белков, секретируемых клеткой или включаемых в наружную мембрану. Секретируемые белки синтезируются на связанных с мембранами рибосомах на цитоплазматической поверхности шероховатого эндоплазматического ретикулума и выводятся из клетки с помощью того же механизма, который используется для включения мембранных белков в эндоплазматический ретикулум.
Если водорастворимый белок не имеет вторичных сигналов сортировки, то он транспортируется к клеточной поверхности и секретируется с помощью «конститутивного» пути. Белки, транспортируемые этим путем, перемещаются из эндоплазматического ретикулума последовательно через различные компартменты комплекса Гольджи и в конце концов попадают на поверхность клетки. Они могут становиться компонентами цитоплазматической мембраны или, при наличии вторичных сигналов сортировки, оставаться в эндоплазматическом ретикулуме (рибофорин, цито-хром Р450) или в комплексе Гольджи (различные гликозилтрансферазы).
В комплексе Гольджи в ходе дальнейшей сортировки отделяются белки, секретируемые конститутивным путем (укороченный путь), от тех, которые направляются в лизосомы или концентрируются в секреторных гранулах, с помощью которых они затем секретируются при соответствующей стимуляции клетки (т. е. регулируемый секреторный путь). Кроме того, обнаружено, что в наружной мембране ядерной оболочки также могут синтезироваться мембранные гликопротеины, которые затем транспортируются с помощью экзоцитоза.Белки при транспортировке по экзоцитозному пути подвергаются посттрансляционным модификациям, в частности гликозилированию. Хорошо изучена компартментация процессинга N-связанного олигосахарида, что очень помогло определению различных компонентов комплекса Гольджи {цис-, медиальных и /пренс-цистерн).
Олигосахаридный предшественник с высоким содержанием маннозы присоединяется по местам гликозилирования в полипептиде (по остаткам аспарагина), когда белок находится внутри эндоплазматического ретикулума, а затем с помощью нескольких расположенных в различных компартментах ферментов осуществляется процесс созревания. Это позволяет следить за превращением белков, определяя состояние их гликозирования.
Исследования выявили несколько замечательных особенностей системы экзоцитозного транспорта.
1. Транспорт между различными компартментами органеллы осуществляется с помощью везикул, которые отпочковываются от «донорной» мембраны и потом сливаются с «акцепторной». Показано, что везикулы, участвующие в транспорте между компартментами комплекса Гольджи, являются «окаймленными», но соответствующий белок отличается от клатрина, окаймляющего эндоцитозные везикулы. Имеются веские данные в пользу того, что клатрин не является существенным компонентом экзоцитозного пути, хотя он, по-видимому, необходим для нормального роста некоторых штаммов дрожжей.
2. Для внутриклеточного транспорта необходим АТР, а также белковые компоненты цитозоля. Показано, что для транспорта между цистернами Гольджи, осуществляющегося при участии везикул, необходимо жирнокислотное производное ацил-СоА . Какую именно функцию выполняют указанные соединения в отпочковывании и слиянии везикул, неизвестно.
