Бактериальная система секреции белков первого типа
Семейство АВС–транспортеров включает в себя специфические АТФ-связывающие белки-транслокаторы. В 1993 году M. J. Fath (M. Fath еt al., 1993) предложил классифицировать их на три группы: эукариотические АВС-транспортеры, бактериальные АВС-ипортеры и бактериальные АВС-экспортеры, на рис.2 представлено строение некоторых из них. Характерно, что ABC-белки являются консервативными и осуществляют трансмембранный перенос большого количества субстратов как в прокариотических, так и в эукариотических клетках. Они наиболее часто состоят из двух закрепленных в мембране гидрофобных и двух консервативных гидрофильных АТФ-связывающих доменов. Эти домены могут быть как частями одного полипептида, так и нескольких отдельных полипептидов. В опытах in vitro было показано, что в ряде случаев этих четырех доменов одного или нескольких полипептидов оказывается достаточно для осуществления трансмембранного перемещения растворов. И все же большинство бактериальных ABC-транспортных систем включает в себя различные дополнительные белки. Этими дополнительными белками являются MFP и OMP (R. Binet et al., 1997).
АВС-импортеры имеют строение, сходное со всеми остальными представителями транспортных АТФ-аз. Но при образовании транспортной системы они присоединяют иные компоненты. В системах, осуществляющих импорт, отсутствуют характерные для системы первого типа OMP и MFP. Вместо них присутствует особый периплазматический белок, который связывается с импортируемым субстратом и предоставляет его АТФ-азе для непосредственного переноса (M. Fath еt al., 1993).
Помимо АВС-экспортеров, осуществляющих транспорт белков, в бактериальных клетках существует обширная группа АВС-экспортеров, выполняющих транспорт небелковых субстратов, например, полисахаридов и ионов. Характерной особенностью этих переносчиков является то, что они сами образуют активную транспортную систему и не требуют никаких дополнительных белков. Транспорт в этом случае осуществляется не во внеклеточное пространство, а в периплазму (M. Saier, 2000).
Подобные АВС-транспортеры обнаружены как в клетках грамположительных и грамотрицательных бактерий, так и в эукариотических клетках (M. Fath еt al., 1993).
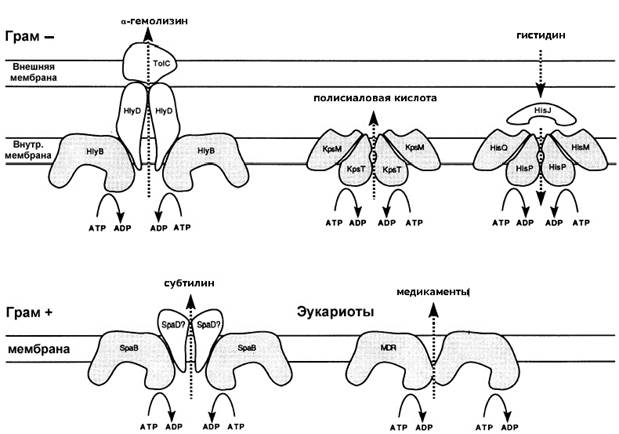
Рис. 2. Строение АВС-транспортеров (по M. Fath еt al., 1993).
Организация генов, кодирующих компоненты системы секреции первого типа
Как правило, гены, кодирующие все три компонента системы, организованы в один оперон, обычно вместе с генами, кодирующими секретируемый белок. К примеру, гены, кодирующие четыре сходных по строению металлопротеазы E. chrysanthemi: PrtA (50кДа), PrtB (53 кДа), PrtC (55 кДа), PrtG (58 кДа) организованы в один оперон с генами, кодирующими все три компонента системы их секреции: PrtD (ABC-транспортер), PrtE (MFP), PrtF (OMP). В случае с E. coli, ген hlyA, кодирующий α-гемолизин, объединен с генами hlyB и hlyD, кодирующими соответственно ABC-транспортер и MFP. Так же дело обстоит и у S. marcescens. Ген hasA, кодирующий внеклеточный гемопротеин, организован в один оперон с генами hsaD (ABC-транспортер) и hasE (MFP). В этих двух случаях ген, кодирующий OMP, в единый оперон не включается и содержится отдельно. Кроме того, у S. marcescens обнаружен оперон, содержащий только гены, которые детерминируют компоненты системы секреции и ни одного гена, ответственного за синтез экспортных белков. Он содержит три гена: lipB (ABC-транспортер), lipC (MFP), lipD (OMP) (H. Akatsuka et al., 1998). Был выявлен также ряд оперонов, которые содержат гены, не относящиеся ни к системе секреции, ни являющиеся генами секретируемых белков. Эти гены кодируют белки, которые тем или иным образом выполняют регуляторную функцию (M. Fath еt al., 1993).
Организация Hly-оперона и некоторых других оперонов представлена на рис. 3. Ген hlyA кодирует 1023 аминокислоты α-гемолизина (HlyA), hlyB кодирует 707 аминокислот ABC-транспортера (HlyB), hlyD кодирует 477 аминокислот MFP (HlyD), и hlyC кодирует 170 аминокислот белка, который не имеет секреторной функции, но облегчает активацию HlyA. Ген tolC, кодирующий 495 аминокислот OMP (TolC) в этот оперон не включается и содержится отдельно.
На данный момент выявлены и расшифрованы опероны систем секреции первого типа многих микроорганизмов (M. Fath еt al., 1993).
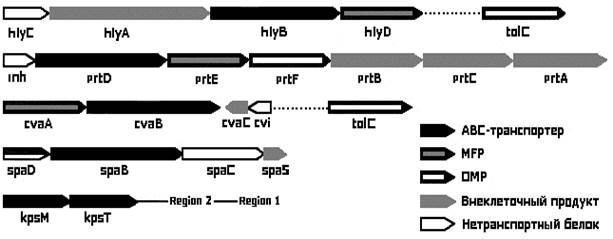
Рис. 3. Оперонная организация генов, кодирующих компоненты системы секреции I типа некоторых бактерий. Сверху вниз: система секреции α-гемолизина E. coli, протеаз E. chrysanthemi, колицина V E. coli, субтилина B. subtilis, капсулярного полисахарида E. coli (по M. Fath еt al., 1993).
Сигнальные последовательности субстратов
Субстраты, секретируемые посредством системы секреции первого типа, не имеют сигнальных амино-концевых последовательностей. Вместо них имеются карбокси-концевые секреторные сигналы, расположенные в пределах последних 60 аминокислотных остатков, впервые обнаруженные на α-гемолизине. В экспериментах с протеазой PrtG E. chrysanthemi было установлено, что наименьшая карбокси-концевая последовательность, позволяющая начать эффективную секрецию, содержит последние 29 аминокислот PrtG, кроме того, низкая, но все же существенная секреция может быть индуцирована последними 15 аминокислотами PrtG (R. Binet et al., 1997). Кроме того, было показано, что карбокси-концевая сигнальная последовательность, состоящая из отрицательно заряженных аминокислотных остатков, является консервативной для гомологичных протеаз. Сравнение последовательностей показало, что протеазы и липазы тоже имеют весьма сходные карбокси-концевые последовательности. Однако важным является тот факт, что гомология последовательностей этих соединений является неполной. А вот секреторные сигналы протеаз и различного рода токсинов являются весьма различными и специфическими, кроме того, комплементация между компонентами систем секреции этих двух семейств белков является очень незначительной. Тем не менее, каждый сигнал может индуцировать секрецию чужеродного белка посредством своего специфического транспортера (R. Binet et al., 1997).
Изучение фрагмента карбокси-конца очищенной протеазы G посредством ЯМР показало, что он представляет собой стабильную α-спираль, расположенную перед 7 – 8 концевыми аминокислотными остатками.
При изучении процессов секреции белков была показана роль особой области, расположенной выше карбокси-концевой сигнальной последовательности на большинстве экспортируемых субстратов. Токсины, протеазы и липазы, секретируемые системой секреции первого типа, имеют такую область, состоящую из богатой глицином последовательности (GGXGXD), которая повторяется 4–36 раз, в зависимости от белка.
При сравнении процессов секреции различных белковых субстратов, содержащих такие последовательности, было установлено, что они играют важнейшую роль при секреции некоторых пептидов. Возможно, что богатые глицином повторы действуют как внутренние шапероны, способствуя лучшему разделению секреторного сигнала и остатка белка (R. Binet et al., 1997).
