Способы подготовки и очистки газов
ВВЕДЕНИЕ
В основную группу процессов очистки и переработки газов входят следующие:
§ Сепарация конденсата – отделение жидкой фазы, выносимой газом из скважины;
§ Сепарация капельной жидкости после отделения основной её части на ступени сепарации конденсата;
§ Отделение вредных примесей – сероводорода и диоксида углерода;
§ Глубокая осушка газа от влаги охлаждением до точки росы (минус 30 °С и ниже);
§ Отбензинивание газа - удаление из него углеводородовот пропана и выше;
§ Извлечение гелия.
К вредным примесям газа относятся ядовитые и корозионно-активные серосодержащие соединения и негорючие инертные газы, снижающие теплоту сгорания углеводородного газа.
В общем случае в углеводородном газе могут содержаться такие серосодержащие соединения, как сероводород, серооксид углерода, сероуглерод, меркаптаны, а в газовом конденсате – также сульфиды и дисульфиды.
В состав инертных газов входят диоксид углерода, азот и гелий.
1. СПОСОБЫ ОЧИСТКИ УГЛЕВОДОРОДНЫХ ГАЗОВ ОТ Н2S, СO2 И МЕРКАПТАНОВ
Для очистки природного газа от Н2S и С02 применяют различные процессы, которые можно разбить на следующие группы:
• хемосорбционные процессы, основанные на химическом взаимодействии Н2S и С02 с активной частью абсорбента;
• процессы физической абсорбции, в которых извлечение кислых компонентов происходит за счет их растворимости в органических поглотителях;
• комбинированные процессы, использующие одновременно химические физические поглотители;
• окислительные процессы, основанные на необратимом превращении поглощенного сероводорода в серу;
• адсорбционные процессы, основанные на извлечении компонентов газа твердыми поглотителями-адсорбентами (молекулярные сита, активированные угли и др.)
Выбор процесса очистки природного газ от сернистых соединений зависит от многих факторов, основными из которых являются: состав и параметры сырьевого газа, требуемая степень очистки и область использования товарного газа, наличие и параметры энергоресурсов, отходы производства и др.
Анализ мировой практики, накопленной в области очистки природных газов, показывает, что основными процессами для обработки больших потоков газа являются абсорбционные с использованием химических и физических абсорбентов и их комбинации. Окислительные и адсорбционные процессы применяют, как правило, для очистки небольших потоков газа, либо для тонкой очистки газа.
К абсорбентам, используемым в промышленности, предъявляются следующие требования:
• недефицитность
• высокая поглотительная способность
• низкая упругость пара
• низкая вязкость
• низкая теплоемкость
• нетоксичность
• селективность (при селективной абсорбции)
Из хемосорбентов наиболее широко применяют алканоламины. Использование химических растворителей основано на химической реакции между хемосорбентом и кислыми компонентами. Максимальная поглотительная способность водных растворов химических абсорбентов ограничена стехиометрией.
Наиболее известными этаноламинами, используемыми в процессах очистки газа от Н2S и С02 являются:
• моноэтаноламин (МЭА)
• диэтаноламин (ДЭА)
• триэтаноламин (ТЭА)
• дигликольамин (ДГА)
• диизопропаноламин (ДИПА)
• метилдиэтаноламин (МДЭА)
Наибольшее практическое применение получили моно- и диэтаноламин. Использование ДЭА особенно целесообразно в тех случаях, когда в исходном газе наряду с Н2S и С02 содержатся COS и СS2, которые вступают в необратимую реакцию с МЭА, вызывая его значительные потери. Для селективного извлечения Н2S в присутствии СO2 используют третичный амин - метилдиэтаноламин.
В физических процессах извлечение кислых компонентов из газа происходит за счет физического растворения их в применяемом абсорбенте. При этом, чем выше парциальное давление компонентов, тем выше их растворимость. Из физических абсорбентов промышленное применение для очистки газов нашли такие, как:
• метанол
• N-метилпирролидон
• алкиловые эфиры полиэтилен гликоля
• пропиленкарбонат
Очистка углеводородных газов этаноламинами
Физико-химические свойства этаноламинов и их водных растворов
Алканоламины (аминоспирты, оксиамины) можно рассматривать как производные аммиака, в котором один или несколько атомов водорода замещены на спиртовой радикал или спиртовой и углеводородный.
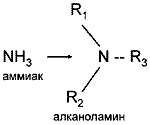
где R - спиртовой радикал, например С2Н4ОН; R2, R3 - либо спиртовой, либо углеводородный радикал, либо Н+.
По степени замещения атомов водорода при атоме азота алканоламины делятся первичные, вторичные и третичные.
Первичные


Вторичные


Третичные


Алканоламины содержат по крайней мере одну гидроксильную (-ОН) и одну аминогруппу
![]()
Присутствие гидроксильной группы снижает давление насыщенных паров и повышает растворимость амина в воде, а аминогруппа придает водным растворам щелочность, необходимую для взаимодействия с Н2S и СO2, которые в водной среде диссоциируют с образованием слабых кислот.
Алканоламины - это бесцветные, вязкие, гигроскопичные жидкости, смешивающиеся с водой и низкомолекулярными спиртами во всех соотношениях; они почти нерастворимы в неполярных растворителях.
Безводные алканоламины применяют, как правило, в виде водных растворов. Концентрация амина в растворе может изменяться в широких пределах, ее выбирают на основании опыта работы и по соображениям коррозии оборудования.
Химизм взаимодействия Н2S, CО2 и других компонентов с этаноламинами.
Алканоламины, будучи щелочами, легко вступают в реакцию с кислыми газами Н2S (СO2), образуя водорастворимые соли. При этом протекают следующие реакции:
Н2S + [Амин] <—> [Амин х Н]++НS+ (мгновенно)
СO2+2х [Амин] <—> [Амин х Н]++ [Амин х СОО]- (быстро)
СO2+Н2O <—> Н2СO3 (медленно)
Н2СO3 <—> Н++ НСO3- (быстро)
НСO3- <—> Н++ СO3- (быстро)
[Амин] + Н+ <—> [Амин х Н]+ (быстро)
Все амины реагируют с Н2S одинаковым образом с образованием гидросульфида или сульфида амина, причем реакция классифицируется как мгновенная.
Первичные и вторичные амины могут реагировать с СO2 с образованием карбамата (соли замещенной карбаминовой кислоты - амин*СОО-*Н+), которая трактуется как быстрая реакция второго порядка. Кроме того, с СO2 образуются карбонаты и бикарбонаты аминов, но образованию их предшествует медленная реакция растворения СO2 в воде с образованием угольной кислоты Н2СO3. Считается, что при умеренных степенях карбонизации амина (до 0,5 моль СO2/моль амина) преимущественно протекает быстрая реакция образования карбамата. Карбаматы аминов - нестойкие соединения и в слабощелочной среде они медленно разлагаются с образованием бикарбоната (на примере вторичного амина):
