Страница
3

В данном случае из-за природы R1, R2 и Z происходит циклизация по Кнорру, однако если Z= ацил, то циклизация может происходить как по Кнорру (путь А), так и по Фишеру-Финку (путь Б) [18].

Ещё одним способом получения пирролов является йодоциклизация алкенилзамещенных b-енаминоэфиров и кетонов с последующим дегидрогалогенированием. Основой для реакции циклизации является имин-енаминное таутомерное равновесие, в котором преобладает енамин.
Было показано, что продукт электрофильной циклизации зависит от относительного положения алкенильной цепи в енаминокетоне, так из a-алкенил-bаминокетонов образуется дигидропирролы (32), а из γ-алкенил-b-аминокетонов- 2-метиленпирролидины (33) [39].

Также было отмечено, что скорость йодоциклизации зависит от заместителя у атома азота, в случае наличия сопряжения скорость увеличивается в 10-20 раз [40].
Дегидрогалогенирование дигидропиррола производят с помощью основания или без него, причем скорость дегидрогалогенирования подчиняется тем же закономерностям, что и скорость йодоциклизации.

Широко используемым может быть метод получения тетразамещенных пирролов из ненасыщенных тиоамидов, включающий образование изотиазолевых солей в качестве интермедиатов в синтезе тиазинов, при удалении из которых серы образуются тетразамещенные пирролы [23].

Из- за сложностей возникающих при попытках получить аминопирролы из незамещенных пирролов, был разработан метод синтеза 3-аминопирролов с хорошими выходами при помощи циклизации Торпа‑Циглера. Метод основан на N-алкилировании b-енаминонитрилов a- галогенкетонами с последующей внутримолекулярной конденсацией по Торпу‑Циглеру [41,42].

Основным требованием данной реакции является выбор алкилирующих агентов имеющих активное метиленовое звено, необходимое для протекания последующей внутримолекулярной конденсации, которая протекает спонтанно или в условиях щелочного катализа метилатом натрия.
2.2. Методы синтеза порфиринов.
Характерной чертой современной химии порфиринов является наличие значительного числа разнообразных методов построения порфиринового макроцикла. Наряду с методами, предложенными в последние годы, достаточно широко используются способы, разработанные в 20-30 годы. Новые методы, потеснив старые, полностью их не исключили. Такое, в общем, не характерное для иных классов биологически-активных соединений, состояние связано, главным образом, с тем, что синтез порфиринов зависит от характера имеющихся в порфирине заместителей и их расположения в макроцикле.
Методы, позволяющие получать сравнительно простые порфирины, совершенно не применимы к более сложным природным порфиринам. И напротив, общие методы, предложенные в последние годы, нецелесообразно применять для получения ряда порфиринов, включая и некоторые природные, поскольку в этом случае неоправданно усложняется синтез исходных пирролов [43].
Синтез порфиринов можно осуществлять двумя основными методами:
1) синтез функциональных порфиринов из непорфириновых предшественников;
2) синтез функциональных порфиринов из заранее полученных незамещенных порфиринов.
Сначала рассмотрим первый, наиболее распространенный, метод получения порфиринов.
2.2.1. Метод Адлера-Лонго.
Метод Адлера-Лонго разрабатывался в середине ХХ века, его часто используют для получения несимметричных замещенных тетраарилпорфиринов. Главной особенностью метода является получение полностью мезо - замещенного порфирина, в мезо‑ положение можно ввести как ароматические заместители [44,45], так и алифатические [46].
Суть метода заключается в конденсации α–незамещенного пиррола с альдегидом, при этом в конденсацию можно вводить смесь различных пирролов и альдегидов, но при этом образуется смесь из всех возможных комбинаций порфиринов и расширенных порфириновых циклов, содержащих 5 и более пиррольных фрагментов [47,48].
Монопиррольная тетрамеризация широко используется, когда целевым является высокосимметричный порфирин, например октаэтилпорфирин или тетрафенилпорфирин, при этом в конденсацию вводят пирролы, у которых в одном из a-положений находится метиленовая группа с легко уходящим остатком, а другое – свободно [49,50].
В последние годы были разработаны методы получения несимметричных порфиринов данным способом, но они требуют тщательного хроматографического разделения продуктов реакции [51].
Тем не менее, оказалось возможным предсказать образование требуемого порфирина, если использовать пиррол, содержащий во втором положении такую уходящую группу, которая была бы настолько реакционноспособна, чтобы ее можно было заместить без кислотного катализа, а образующийся порфириноген быстро бы окислялся в порфирин. Идеальной уходящей группой оказалась диметиламинометильная группа, благодаря которой конденсацию можно проводить действительно в нейтральных условиях. Более того, оказалось возможным получить региохимически чистый порфирин (с одинаковыми пиррольными кольцами напротив друг друга) при использовании пиррола с двумя диметиламинометильными группами и пиррола, не содержащего заместителей в a-положениях пиррольного цикла, выход составил 10-20% [52].
При необходимости реакционную способность диалкиламинометильной группы увеличивают путем проведения реакции кватернизации, при этом выход порфириновой конденсации увеличивается до 20%.
2.2.2. “2+2” порфириновый синтез.
Этот метод основан на конденсации двух молекул дипиррометанов. Существенным преимуществом синтезов порфиринов через дипирролилметаны является то, что последние получаются с достаточно высокими выходами, особенно при наличии электронодонорных заместителей в пиррольном цикле [53].
Первоначальный метод Макдональда включал использование одного дипиррометана, содержащего две формильные группы в α‑положениях и другого α‑свободного или содержащего карбоксильные группы дипиррометана [33,54,55].

Линдсей с соавторами синтезировали порфирины, содержащие 4 различных мезозаместителя, с помощью модифицированного метода Макдональда [56,57]. В качестве заместителей в мезо- положениях выступали алкил- и галоген замещенные бензолы, выход требуемого продукта достаточно высок для порфиринового синтеза и составил 14%.
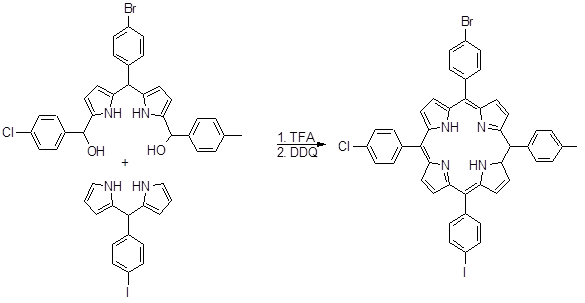
Оно и сотрудники использовали 5,5’-бис(гидроксиметил)дипиррометаны для получения несимметричных порфириновых димеров [58]. Андерсон синтезировал порфириновые димеры, используя замещенные дипиррометан и триметилсилилпропиналь, как один из углеродных фрагментов. Несимметричные мезо-арилпорфирины с заместителями в β‑положениях пирольного цикла также были синтезированы данным способом. Огоши с соавторами синтезировали 5,15-дифенил-10-р-хлорфенил-2,3,17,18-тетраэтилпорфирин с выходом 9% [59].
